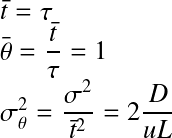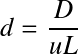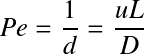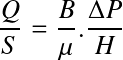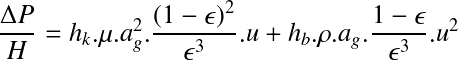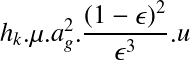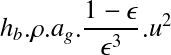Objectifs
Apprentissage des notions théoriques relatives aux principaux procédés séparatifs utilisés en traitement des eaux de consommation
Dimensionner les opérations unitaires physico-chimiques de clarification, adsorption, désinfection : volumes, débits d'eau à traiter, surface des décanteur et filtres, dosage des réactifs, asservissement
Réacteurs - Typologie et régimes d'écoulement
Classification des réacteurs en génie des procédés et utilisation en traitement des eaux
Fondamental :
Le traitement des eaux est réalisé via des opérations unitaires de type physique, chimique et biologique. Ces opérations sont réalisées au sein de cuves, récipients appelés communément « réacteurs ».
La classification des réacteurs se fait selon trois principaux critères :
la présence d'entrées et sorties :
les réacteurs ouverts (ou continus) : volume et densité constants (débit d'entrée = débit de sortie) ou volume volume variable ;
les réacteurs fermés (ou discontinus) dit « réacteur en batch » ;
les réacteurs semi-continus ;
l'hydrodynamique du réacteur :
les phases en présence : fluides (eau, air...) et solides (supports, microorganismes floculés...) : réacteurs monophasiques, à lit fixe (en anglais : « packed bed reactor »), à lit fluidisé (en anglais : « fluidized bed reactor »)
Réacteurs idéaux
Réacteur fermé, discontinu
Pour ce type de réacteur, les flux entrants et sortants sont nuls durant la réaction (le réacteur fonctionne selon un cycle de remplissage, réaction, vidange). Le contenu du réacteur est supposé complétement agité.
Type de réacteur | Applications en traitement des eaux usées | Applications en traitement des EDCH |
|---|---|---|
Fermé | Traitement biologique en réacteur séquentiel (Sequencing Batch Reactor) | |
Mélange/préparation de réactif (par ex. : lait de chaux | ||
Réacteur continu parfaitement agité (RPA)
Au sein de ce type de réacteur, on suppose idéalement un mélange instantané et uniforme du milieu réactionnel dans l'ensemble du réacteur, à mesure que le fluide pénètre dans le système. Les particules de fluide quittent le réacteur en fonction de leur distribution statistique. Les conditions de mélange parfait sont atteintes au sein de réacteurs de forme circulaire ou rectangulaire si le contenu est distribué de manière uniforme et continue. Le temps requis pour atteindre ces conditions - appelé temps de mélange - est fonction de la géométrie du réacteur ainsi que du type et de la puissance d'agitation.
Le volume et la densité sont constants (débit d'entrée = débit de sortie). Les concentrations et température du flux de sortie sont les mêmes que celles dans le réacteur.
Type de réacteur | Applications en traitement des eaux usées | Applications en traitement des EDCH |
|---|---|---|
RPA | Coagulation Floculation Désinfection Réacteur à charbon actif en poudre (CAP) | |
RPA avec recyclage | Traitement biologique par boues activées (bassin dit "à mélange intégral") |
Réacteur piston (RP)
Dans des conditions idéales, les particules de fluide passent à travers le réacteur avec très peu ou pas du tout de mélange longitudinal : elles quittent le réacteur dans le même ordre que celui dans lequel elles sont entrées. Le temps de séjour, dans les conditions idéales, est égal au temps de séjour théorique. Ce type d'écoulement est approché au sein de réacteurs de forme allongée (rapport longueur/largeur élevé) où la dispersion longitudinale est minimale voire absente, ou encore de réacteur tubulaires fermés (une canalisation par exemple !).
Type de réacteur | Applications en traitement des eaux usées | Applications en traitement des EDCH |
|---|---|---|
Piston | Lagunage naturel Désinfection | Oxydation Désinfection |
Piston avec recyclage | Traitement biologique par boues activées |
Association de réacteurs
Cascade de réacteurs
Ce type de réacteur est caractérisé par une succession de réacteurs (plusieurs réacteurs continus ou un duo réacteur continu-réacteur à écoulement piston par exemple). Le flux de sortie du premier réacteur sert de flux d'entrée au second réacteur et ainsi de suite. Cette configuration permet d'atteindre des conversions très élevés.
On peut parfois rencontrer physiquement des systèmes se rapprochant de ce type de configuration dans le cadre de certaines filières de traitement.
Type de réacteur | Applications en traitement des eaux usées | Applications en traitement des EDCH |
|---|---|---|
Réacteurs en cascade | Lagunage multiétagé (3 réacteurs en série usuellement) Filtres plantés de roseaux à écoulement vertical Réacteurs à boues activées "multizones", par exemple : zone de contact, zone anaérobie, zone anoxique, zone aérobie. | Tours d'ozonation |
Utilisé pour simuler les écoulements non-idéaux | ||
Réacteurs polyphasiques
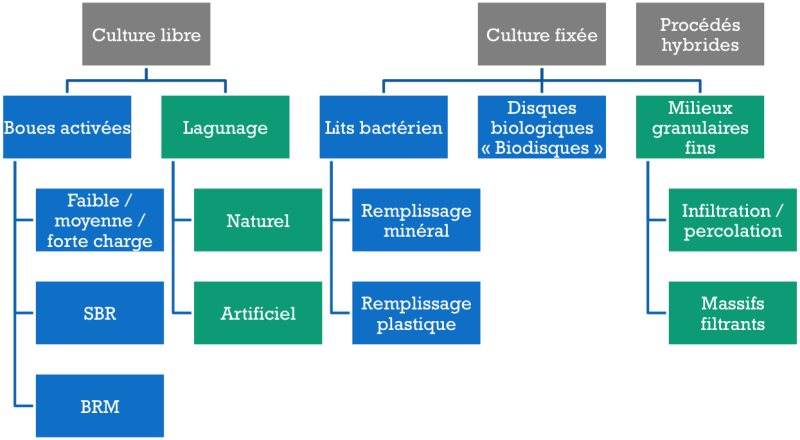
Réacteur à lit fixe
Ce type de réacteur est rempli avec un garnissage de type minéral ou plastique (pouzzolane, céramique, charbon actif) formant une phase solide. En fonction de la direction du flux, le lit fixe peut être exploité en mode ascendant ou descendant. L'injection peut être réalisée de manière continue ou discontinue (par bâchées). Le garnissage peut être disposé de manière continue ou en plusieurs étages. Une injection de gaz (air) nécessaire à la réaction est possible : dans le cas ou les flux liquide et gazeux sont dans la même direction, on parle de réacteur à co-courant, et dans le cas inverse de réacteur à contre-courant.
En termes de modélisation hydrodynamique, ce type de réacteur s'approche souvent du comportement d'un réacteur piston non idéal.
Type de réacteur | Applications en traitement des eaux usées | Applications en traitement des EDCH |
|---|---|---|
Lit fixe | Biofiltres Lits bactériens Massifs filtrants plantés ou non Désodorisation | Adsorption (Charbon Actif en Grains) Filtration biologique (déferrisation, démanganisation Reminéralisation sur filtres calcaires |
Réacteur à lit fluidisé
Le réacteur à lit fluidisé est très similaire au lit fixé à l'exception du fait que le garnissage est mis en expansion via le mouvement ascendant du fluide (air et/ou eau) à travers le lit. La porosité du lit fluidisé peut alors être contrôlée via le débit du fluide.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
En termes de modélisation hydrodynamique, ce type de réacteur s'approche souvent du comportement d'un réacteur piston non idéal.
Type de réacteur | Applications en traitement des eaux usées | Applications en traitement des EDCH |
|---|---|---|
Lit fluidisé | Traitement biologique aérobie ou anaérobie (effluents industriels chargés) | Phases de lavage de réacteurs à lit fixe (filtres à sable, à charbon actif en grain) |
Cinétiques réactionnelles
Lors du choix et de la conception d'un procédé, la stœchiométrie et les vitesses réactionnelles constituent des paramètres fondamentaux. La stœchiométrie définira les quantités de matières constituant les réactifs et les produits de la réaction tandis que les paramètres cinétiques définiront la vitesse d'apparition ou de disparition d'un composé.
Définition : Vitesse de réaction
Ce terme est utilisé pour décrire l'évolution (augmentation ou diminution) de la quantité de matière d'un composé par unité de volume par unité de temps. Pour les réactions hétérogènes, on peut également l'exprimer par unité de surface ou de masse par unité de temps. Ainsi, pour une réaction homogène, on définit la vitesse de réaction r par :
![Équation en notation Latex : r=\frac{1}{V}\frac{d[N]}{dt}](res/cours_cinetiques.png)
avec :
r = vitesse de réaction (mol.m-3.s-1) ;
[N] = quantité de matière (mol) ;
V = volume de contrôle (m3) ;
t = temps (s) ;
Si l'on remplace N par son équivalent V*C (volume en m3 multiplié par concentration en mol.m-3), l'équation précédente devient :
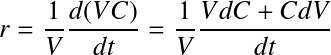
Dans le cas où le volume de contrôle reste constant (condition isothermes, pas d'évaporation, réacteur fermé), cette équation se simplifie alors pour donner :
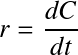
Cette expression peut être positive, indiquant une augmentation de la concentration avec le temps, alors qu'une valeur négative indique une diminution de celle-ci durant la réaction.
En traitement des eaux, les vitesses de réaction sont d'une grande importance. En effet, les réactions mises en jeu sont souvent trop lentes pour être complétées durant le temps imparti. Les procédés de traitement sont alors conçus sur la base des cinétiques réactionnelles plutôt que sur la base de leur équilibre stœchiométrique.
Expression de vitesses de réaction couramment rencontrées en traitement des eaux
La vitesse de réaction peut généralement être exprimée en fonction de la concentration d'un réactif ou d'un produit de la réaction en fonction du temps. Les résultats obtenus sont en général comparés à un certain nombre d'équations standard (modèles cinétiques). Un certains nombre de modèles de réactions courants en traitement des eaux sont reportés dans le tableau suivant :
Fondamental : Temps de contact ou Temps de Séjour Hydraulique
Connaissant le temps nécessaire pour qu'un réaction aboutisse à un objectif donné (abattement), on peut donc en déduire le temps de contact nécessaire au sein du réacteur de traitement. Celui-ci est également appelé le TSH et s'exprime comme le rapport du volume du réacteur concerné par le débit à traiter :
Flux au sein des réacteurs et dimensionnement
Introduction
Une fois le temps de contact requis pour un traitement donné connu, il convient de dimensionner (calculer le volume !) du réacteur qui mettra en jeu cette réaction. Il convient de s'assurer que le temps de séjour en question soit respecté, ceci en mettant en œuvre une hydrodynamique adaptée au sein du réacteur (degré de mélange, géométrie...). Ce qui suit vous sensibilisera aux différents comportements hydrodynamiques rencontrés et vous apprendra comment procéder au dimensionnement générique de réacteurs.
Visualisation des flux au sein des réacteurs
Réacteur agité
Les vidéos suivantes présentent des expériences de traçage effectuée sur des réacteur agités (parfaitement ?) et piston (idéal ?) respectivement. On peut y visualiser le transport d'un composé dissous.
Bilan matière
La détermination des caractéristiques hydrodynamiques d'un réacteur ou d'une portion de réacteur (masse d'eau), ainsi que la caractérisation des conversions et réactions s'y déroulant, passent par une approche fondamentale : le bilan matière ou bilan masse.
Fondamental : Principe
Le principe fondamental est celui de la conservation de la matière, exprimé entre autre par la célèbre formule d'Antoine Lavoisier « Rien ne se perd, rien ne se crée, tout se transforme »
.
Pour établir un bilan matière sur un réacteur, il est primordial de définir :
Le système étudié et ses limites : il s'agit alors d'identifier l'ensemble des flux entrants et sortants,
Le volume de contrôle : volume au sein duquel se déroulent les conversions chimiques, physiques ou biologiques d'intérêt.
Dans la plupart des cas, le système et le volume de contrôle coïncident. Ainsi, pour un réactif donné, le bilan matière est donné par l'expression suivante :

En d'autres termes :
En fonction des caractéristiques hydrauliques et du composé considéré, certains termes de cette relation peuvent s'annuler. Par exemple :
En batch, les termes « Entrée » et « Sortie » sont par définition nuls,
Dans le cas d'un composé inerte entrant dans le réacteur (traceurs conservatifs), le terme de production est nul.
Dans l'équation, le terme puit/source est positif dans la mesure ou le signe final dépendra de celui de l'expression de la vitesse de conversion du composé considéré :
Production (par exemple de nitrates dans un procédé à boues activées au cours de la nitrification) = signe +
Dégradation (par exemple traitement de la pollution carbonée des eaux usées) = signe -
Méthode : Établissement d'un bilan matière en régimes transitoire et permanent
L'établissement d'un bilan matière doit toujours suivre les étapes suivantes :
Préparer un diagramme simplifié du système ou procédé considéré pour le bilan en faisant figurer l'ensemble des flux entrants et sortants,
Définir les limites du système et du volume de contrôle. Cette étape est cruciale dans la mesure où il est souvent possible de simplifier les calculs si le choix est réalisé judicieusement,
Lister l'ensemble des données disponibles et des hypothèses de travail et les reporter sur le diagramme,
Lister l'ensemble des expressions des vitesses de conversion se déroulant dans le volume de contrôle,
Exprimer le bilan matière et le résoudre (solution analytique, méthodes numériques, méthodes graphiques,...).
Définition : Régime transitoire vs. Régime permanent
En génie chimique, le régime transitoire est défini par la présence du terme d'accumulation dans le bilan matière. Le réacteur est « instable », les concentrations des différents composants du système varient avec le temps, cela peut être le cas par exemple lors du démarrage d'une installation ou plus généralement de variations temporelles des caractéristiques de l'alimentation (débits, concentrations), des constantes réactionnelles, des conditions opératoires, etc. En résolvant un bilan matière en régime transitoire, on va chercher à caractériser la dynamique d'un système. Cela est souvent appliqué lorsque l'on utilise la modélisation dite dynamique pour prédire les concentrations de sortie en fonction de variations des conditions opératoires.
Le régime permanent est quant à lui défini par l'annulation du terme d'accumulation. C'est le cas lorsque les conditions opératoires sont constantes, que le réacteur est régime « établi », dit stationnaire. Les valeurs des variables d'état du système (concentrations,...) sont alors constantes. On cherche alors à déterminer la concentration du composé à l'état permanent, sur le long terme. C'est l'approche qui est souvent utilisée lors du dimensionnement des installations.
Flux au sein d'un réacteur Parfaitement Agité
Considérons l'injection d'un composé non réactif (on parle de traceur conservatif) sous forme d'une impulsion (« pulse ») à l'entrée d'un RPA alimenté de manière constante en eau claire. On prend pour hypothèse que le traceur se mélange instantanément donc la concentration au sein du réacteur est égale à celle de sortie. Écrivons le bilan matière correspondant : |
Le traceur est conservatif, le terme puit/source est nul. On peut donc écrire :
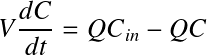
avec :
Cin = concentration du traceur injectée en entrée (mol.m-3)
C = concentration du traceur mesurée dans le réacteur ou en sortie (mol.m-3)
V = volume de contrôle (m3)
t = temps (s)
L'injection du traceur est sous forme d'impulsion, on peut prendre comme hypothèse durant les mesures suivant l'injection Cin≈0 mol.m-3. La réécriture du bilan donne alors :
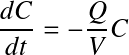
L'intégrale entre les limites de C = C0 (concentration initiale, immédiatement après l'injection = masse de traceur injectée/volume) à C = C et t de t = 0 à t = t s'écrit :
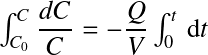
L'expression résultante après intégration est :
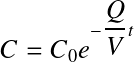
On voit apparaître les paramètres suivants :
Le temps de séjour hydraulique (TSH)
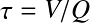 (s) ;
(s) ;Le temps de séjour adimensionnel
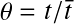 avec
avec  = temps de séjour moyen ;
= temps de séjour moyen ;
On peut donc réécrire l'équation précédente :
![]()
Remarque :
Dans un RPA idéal, ![]() .
.
Complément :
Lors d'une injection sous forme d'échelon, l'équation correspondante est :
![]()
La courbe de traçage théorique d'un RPA peut donc être représentée comme suit :
Flux au sein d'un réacteur piston idéal
L'injection d'un traceur conservatif au sein d'un réacteur piston est réalisée après avoir prérempli ce dernier avec de l'eau claire. Dans le cas d'un réacteur idéal, le temps de séjour mesuré est alors égal au temps de passage (V/Q).
Si l'on réalise le bilan matière d'un traceur conservatif (injection sous forme d'échelon) sur un volume élémentaire dV défini sur la section transversale d'un réacteur piston, on obtient la relation suivante (hypothèse : la concentration C du traceur est uniforme sur la section) :
Soit :
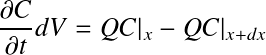
avec :
∂C/∂t = variation de concentration du traceur (mol.m-3.s-1)
dV = volume élémentaire (m3)
t = temps (s)
Q = débit (m3.s-1)
x = abscisse quelle conque sur la longueur de réacteur L (m)
dx = longueur élémentaire (m)
Après un développement limité, on peut réécrire l'équation précédente comme suit :
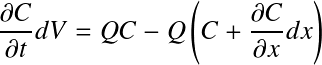
En posant A = aire de la section transversale dans la direction x (m2), on a : dV=Adx, ce qui permet d'écrire :
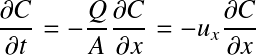
avec :
ux = vitesse du fluide dans la direction x (m.s-1)
L'observation de cette équation de transport met en évidence que ses deux termes, hormis le signe, sont identiques : la seule solution admise implique dès lors une variation de la concentration sur la distance nulle. C'est à dire que la concentration en sortie est égale à la concentration en entrée avec seulement un « effet retard ».
Ainsi la réponse d'un réacteur piston idéal à une injection de traceur conservatif peut être représentée de la manière suivante :
Exercices
Considérant une cinétique de dégradation de second ordre pour un composé A, calculer le volume (en m3) de réacteur nécessaire pour aboutir à un abattement de 90% à l'état stationnaire (régime permanent) dans le cas d'un RPA.
Données :
Concentration du composé A à l'entrée du réacteur C0 = 1 mol.L-1
Constante cinétique de second ordre k = 10 L.mol-1.min-1
Débit d'alimentation Q = 30 m3.h-1
Pour répondre à cette question, vous devrez établir le bilan-matière au niveau du réacteur étudié. On supposera le régime permanent (le terme d'accumulation = variation au cours du temps s'annule). Le fait d'être en RPA permet également de simplifier le problème en éliminant une inconnue.
Considérant les mêmes données que l'exercice précédent, calculer le volume (en m3) de réacteur nécessaire pour aboutir à un abattement de 90% à l'état stationnaire dans le cas d'un réacteur piston idéal.
Données :
Concentration du composé A à l'entrée du réacteur C0 = 1 mol.L-1
Constante cinétique de second ordre k = 10 L.mol-1.min-1
Débit d'alimentation Q = 30 m3.h-1
Pour répondre à cette question, cela est plus complexe que dans l'hypothèse d'un réacteur parfaitement agité. La non-homogénéité des concentrations au sein du réacteur implique une variation dans le temps et dans l'espace de la concentration. Le bilan-matière s'effectue alors à l'échelle d'un volume élémentaire du réacteur aboutissant à une équation de transport (équation aux dérivées partielles). On supposera le régime permanent (le terme d'accumulation = variation au cours du temps s'annule).
La vitesse ux correspond alors au ratio du débit sur la section de passage A du réacteur de longueur notée L.
Il faut rajouter à cette équation le terme cinétique et l'intégrer entre l'abscisse x = 0 et l'abscisse x = L.
Critères de choix d'un type de réacteur
Pour une conversion donnée, le choix du type de réacteur (parfaitement agité, piston, réacteurs en série...) va dépendre, entre autres, du volume nécessaire pour aboutir au degré de conversion désiré. Ainsi, en fonction de la cinétique réactionnelle considérée (premier ou second ordre, avec saturation, etc.), le volume de réacteur nécessaire pour atteindre le degré de conversion désiré varie en fonction du type de réacteur choisi.
D'autres critères peuvent entrer en ligne de compte :
Le réacteur fermé constitue une installation simple. Il permet d'imposer facilement des variations des conditions opératoires (température, etc.) au cours de la réaction. En revanche, les concentrations élevées rencontrées en début de réaction peuvent poser problème dans le cas de composés toxiques. En termes d'exploitation, le fonctionnement séquentiel impose des temps morts (vidange, remplissage) qui nuisent à la productivité globale.
Le réacteur de type parfaitement agité permet d'obtenir un rendement de conversion très stable sur une longue période de temps. Le fait de travailler à de faibles concentrations de réactifs permet une meilleure sécurité (cas de réactifs toxiques) ainsi qu'une meilleure conversion pour les ordres de réactions inférieurs à 1 ou en cas d'inhibition par le substrat. En revanche, pour les ordres de réaction supérieurs à 1 ou en cas d'inhibition par le produit, la conversion est moins bonne. Les flux d'entrée et de sortie doivent être contrôlés de manière très rigoureuse.
Le réacteur à flux piston offre des performances très élevées. Il permet l'obtention d'un gradient de concentration sur la longueur du réacteur qui peut être bénéfique pour le système, par exemple dans le cas du contrôle de la croissance de microorganismes filamenteux au sein du procédé à boues activées.
Dans la pratique, les coûts de construction, la place disponible ainsi que les contraintes d'exploitation et de maintenance constituent également des critères essentiels du choix du type de réacteur.
Conclusion
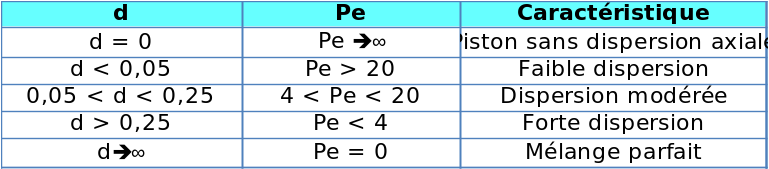
Les bilans que nous venons d'aborder ici sont valables pour des réacteurs idéaux. Dans le cas des réacteurs réels, la non-idéalité de l'écoulement est à prendre en compte pour une description détaillée du système et notamment une modélisation. En pratique, l'obtention de réacteurs pistons idéaux impossible : il faut prendre en compte le phénomène de dispersion et réécrire le bilan du réacteur piston avec dispersion. On peut aussi modéliser un réacteur piston avec plus ou moins de dispersion selon le modèle des réacteurs agités en cascade. Cela sort du cadre de ce module 2 mais vous pouvez aller consulter ces liens pour aller plus loin.
La plupart du temps, lors de la conception de filières de traitement des eaux, on fait l'hypothèse de réacteurs idéaux, ce qui amène à l'utilisation, selon les cas, de facteurs de sécurité. C'est bien sûr une approche empirique et les recherches et développements ne cessent de chercher à établir des modèles plus précis offrant u compromis entre aspects opérationnels et précision !
Clarification des eaux
Introduction
La présence dans l'eau de diverses substances en suspension (MES) constitue bien souvent la partie plus apparente de la pollution.
Cette partie pourra être éliminée par divers procédés :
action directe de la pesanteur : c'est la décantation.
action mécanique : c'est la filtration ou le tamisage.
La clarification est l'opération qui assure l'élimination des matières en suspension (MES), des matières colloïdales et des macromolécules susceptibles de communiquer à l'eau une turbidité et une couleur indésirables. Elle élimine en même temps la fraction des polluants (organiques, minéraux et bactériens) qui est associée à ces MES et macromolécules.
Les procédés de coagulation-floculation sont utilisés pour faciliter l'élimination des MES et des colloïdes avant une phase de séparation (décantation et/ou filtration).
Décantation
Introduction
En fonction de la concentration et du type de particules, on distingue plusieurs régimes de décantation :
décantation discrète, de particule isolée ;
décantation de zone, freinée ;
compression.
En traitement des eaux, ces différents régimes se retrouveront à des degrés divers en fonction des ouvrages et des applications considérés. En eau potable, nous allons essentiellement travailler dans le domaine de la décantation discrète. Les deux autres régimes seront abordés dans les cours relatifs au traitement des eaux usées.
Coagulation et floculation | Décantation | |
|---|---|---|
Eaux de consommation | Déstabilisation des suspensions colloïdales pour amélioration de la décantation et/ou de la filtration | Élimination des MES Réduction de la turbidité, de la couleur |
Eaux résiduaires | Parfois utilisée en traitement primaire (amélioration de la décantation primaire) Traitement tertiaire | Décantation primaire Décantation secondaire Traitement tertiaire (après précipitation du phosphore) |
Décantation discrète
Définition :
La décantation discrète correspond à de faibles concentrations en particules. Le comportement de la suspension est alors gouverné par les propriétés individuelles de chaque particule. Il n'y a pas d'interactions entre particules.
Complément :
Ce régime est observé notamment au sein des dessableurs et des décanteurs primaires utilisés en traitement des eaux usées.
La vitesse de chute de particules dans un fluide est considérée comme équivalente à celle d'une particule isolée tant que la distance moyenne entre particules est supérieure à 10 fois leur diamètre (concentration en MES inférieure à 1 g/L en général) et ne dépend que des propriétés du fluide et des caractéristiques des particules.
Le déplacement d'une particule est décrite par la force appliquée F proportionnelle à la masse m et à son accélération ![]() égale à la résultante de son poids F1 diminuée de la poussée d'Archimède F2 et de la force de frottement F3 (principe fondamental de la dynamique) :
égale à la résultante de son poids F1 diminuée de la poussée d'Archimède F2 et de la force de frottement F3 (principe fondamental de la dynamique) :
![]()
Avec
Poids F1 :
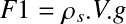 :
:ρs : masse volumique du solide
V : volume de la particule
g : accélération pesanteur (9,81 m/s2)
Poussée d'Archimède F2 : Archimède :
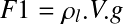
ρl : masse volumique du liquide
Force de résistance opposée par le fluide, fonction de la taille, de la forme, de la rugosité de la particule et de la viscosité du liquide :
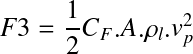 :
:A : surface de projection des particules sur un plan perpendiculaire au déplacement
CF : coefficient de frottement (trainée) dépendant du régime hydrodynamique
vP la vitesse de la particule.
Soit pour une particule sphérique, la force P due au champ d'accélération :
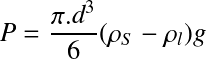
L'expression de F devient alors :
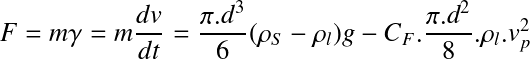
A vitesse constante, la résultante s'annule et l'expression devient :
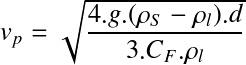
Le coefficient de trainé CF est fonction du régime hydrodynamique, caractérisé par le nombre de REYNOLDS Re de la particule dans le milieu fluide considéré :
avec :
µ : viscosité dynamique du fluide (Pa.s)
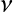 : viscosité cinématique du fluide.
: viscosité cinématique du fluide.
• Si Re <10-4 : domaine dans lequel le mouvement des particules est influencé par le mouvement brownien; la loi de vitesse n'est pas applicable ;
• Si 10-4 <Re<1 : domaine du régime laminaire, CF = 24/Re. La vitesse limite de chute vp est donnée par la formule de STOCKES:
Si 1<Re<103, le régime est de transition, CF est complexe et varie de façon continue. Le diamètre des particules est en général compris entre 10-4 m et 10-3 m. La valeur du coefficient de frottement est donnée par la formule de ALLEN :
Si 103<Re<2.105, le régime est turbulent, CF est indépendant du nombre de Reynolds et est égal à 0,4 d'où la loi de NEWTON :
La vitesse de chute est proportionnelle à la racine carrée du diamètre. Les particules ont en général un diamètre > 1mm
Si Re >2x105 : la loi de vitesse n'est plus applicable ;
Influence de la floculation
Des particules plus ou moins floculées ont des tailles et des vitesses de décantation variables du fait des variations des propriétés des particules suite à l'ajout de coagulant et floculant ainsi que de l'hydrodynamique (cisaillement, gradient de vitesse). Dans ce type de suspensions généralement faiblement concentrées dont les particules ont tendance à s'agglomérer et à floculer ensemble, la vitesse de chute aura tendance à augmenter avec le temps. La floculation peut être initiée via l'ajout de réactifs ou via les propriétés intrinsèques des particules (cas de la biofloculation notamment).
Complément :
En traitement des eaux, ce régime se rencontre couramment après une étape de coagulation-floculation : clarification d'eaux de surface (potabilisation), traitement tertiaire d'eaux usées, traitement physico-chimique d'eaux pluviales ou industrielles...
Les flocons formés lors de la floculation se comportent, comme des particules de dimension supérieure à celle des particules individuelles et de masse volumique intermédiaire entre celle du solide et celle du liquide.
La densité des particules est comprise entre 1 et 2.
La sédimentation est perturbée par l'agglomération de particules d'où un accroissement de la taille des particules et la modification de leur densité (eau interstitielle). Plus la trajectoire des particules est grande, plus la probabilité de rencontre est grande.
La décantation d'une solution diluée de particules floculantes est fonction des caractéristiques de décantation, et de leurs caractéristiques de floculation. L'agglomération des particules favorise la décantation, même si la densité des particules résultantes est inférieure à celle des particules initiales, puisque la vitesse de décantation est fonction du diamètre (la vitesse est proportionnelle au carrée du diamètre), de la densité des particules, ainsi que de la viscosité dynamique de l'eau.
Fondamental :
L'agglomération de particules est d'autant plus grande que :
la concentration de la suspension est élevée ;
les particules ont des tailles et des masses différentes ;
la viscosité du liquide de suspension est basse.
Le taux de floculation des particules est fonction :
de la distance que les particules parcourent
de la charge superficielle
des gradients de vitesse dans le bassin
de la concentration des particules
du diamètre des particules.
On ne dispose pas d'expressions mathématiques permettant de quantifier l'influence de la floculation sur la décantation, car la vitesse de chute des particules floculantes varie le long de leur trajet. La trajectoire de chute sera curviligne. Actuellement, seule l'étude expérimentale permet de calculer l'ouvrage devant traiter ces suspensions. Cependant on peut définir empiriquement la vitesse de chute d'une particule par :
![]()
avec p : le pourcentage d'élimination et ![]() : coefficient rendant compte du caractère floculant de la suspension.
: coefficient rendant compte du caractère floculant de la suspension.
On établit alors des courbes d'isoconcentrations, servant de base au calcul du bassin à l'aide de colonne de la même hauteur qu'un décanteur classique (entre 1,8 et 2,4m), de diamètre suffisant pour éviter les effets de parois (20-30 cm) et permettant des prélèvements fonction de la hauteur (0,6, 1,2, 1,6) et du temps.
Principe de dimensionnement d'un décanteur
Supposons un décanteur rectangulaire idéal. Le débit est distribué uniformément en entrée et en sortie sur toute la section.
On suppose :
Zone entrée : débit distribué uniformément, zone agitée
Zone décantation : zone calme, écoulement laminaire
Zone de sortie : évacuation de l'eau décantée
Zone boues : accumulation des solides
La particule qui entre dans l'ouvrage est soumise à un champ de vitesse dont les composantes sont :
vP : vitesse verticale de chute (Stokes) ;
vT : vitesse traversière liée à la vitesse du fluide (advection).
On a alors :
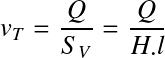
avec :
Q = débit (m3/s)
H = hauteur de l'ouvrage (m)
l : largeur de l'ouvrage (m)
SV = section de passage de l'écoulement (m2)
Pour qu'une particule soit retenue, la condition suivante doit être respectée :
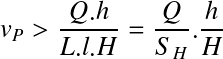
avec :
L : longueur du décanteur (m)
h = hauteur d'introduction de la particule (m)
SH = surface horizontale (m2)
Définition :
On définit la vitesse de Hazen comme le ratio du débit d'eau à traiter sur la surface horizontal de décantation :
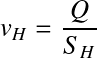
Fondamental : Condition de rétention des particules
La vitesse de Hazen (et donc la surface horizontale de décantation), constitue le principal critère de dimensionnement d'un ouvrage de décantation.
Elle est indépendante de la profondeur dont le choix influera surtout sur la possibilité de stocker des boues au fond de l'ouvrage ainsi que sur le maintien de conditions hydrodynamiques favorables à l'absence de départ de boues.
Les particules dont la vitesse de chute est supérieure à la vitesse de Hazen (vP > vH) seront éliminées à 100% quelque soit leur hauteur d'introduction.
Les particules dont la vitesse de chute est inférieure à la vitesse de Hazen (vP < vH) seront éliminées selon le rapport vP/vH.
Attention :
Bien qu'ayant la même unité, la vitesse de Hazen ne doit pas être confondue avec la vitesse ascensionnelle ou charge hydraulique superficielle.
La vitesse de Hazen se calcule en prenant en compte l'ensemble de la surface projetée horizontale disponible de l'ouvrage (incluant les lamelles présentes dans un décanteur lamellaire).
La vitesse ascensionnelle se calcule en prenant en compte uniquement la surface au miroir (≈ encombrement au sol).
Dans le cas d'un décanteur classique, les deux vitesses ont la même valeur.
Dans le cas d'un décanteur lamellaire, la vitesse ascensionnelle sera plus élevée que la vitesse de Hazen.
Exercice : Vitesse de Hazen vs vitesse ascensionnelle
La démonstration précédente fait apparaître la surface du décanteur comme principal critère de dimensionnement.
Connaissant le débit de votre eau à traiter (120 L/h) et la surface au miroir du décanteur pilote (0,1 m2), calculez la vitesse au miroir (ou vitesse ascensionnelle ou encore charge hydraulique superficielle) appliquée à votre décanteur.
L'ordre de grandeur obtenu est-il satisfaisant ?
Quel rôle des lamelles selon vous ?
Décantation lamellaire
Définition : Principe de fonctionnement
Il s'agit d'ouvrages de décantation dans lesquels des lamelles parallèles inclinées permettent de multiplier la surface utile de décantation tout en réduisant la surface au sol par rapport à un ouvrage de décantation classique à flux horizontal. L'ajout de modules lamellaires peut être réalisé en réhabilitation d'un ouvrage existant ou lors de la conception d'un ouvrage neuf. Les décanteurs utilisant des plaques ou des tubes assemblés sous forme d'une structure type "nid d'abeilles" permettent ainsi d'améliorer considérablement l'efficacité de décantation par rapport à un décanteur classique.
Schéma de principe
La décantation lamellaire est fondée sur le principe de la décantation à flux horizontal. Ainsi, on constate que la décantation d'une particule est liée uniquement au débit Q et à la surface horizontale S, et qu'elle est théoriquement indépendante de la hauteur H de décantation. Si on répartit le débit Q sur n lamelles parallèles de surface unitaire ![]() , on obtient une décantation théoriquement identique à celle obtenue dans le bassin de la figure ci-dessous.
, on obtient une décantation théoriquement identique à celle obtenue dans le bassin de la figure ci-dessous.
Afin de pouvoir extraire en continu les solides décantés, et pour des raisons pratiques de fonctionnement et d'exploitation, les lamelles sont inclinées d'un angle α , souvent de 60° par rapport à l'horizontale (entre 30 et 60° cas général selon le type de décanteur). Une telle disposition permet pour un rendement identique d'obtenir des ouvrages plus compacts qu'un bassin classique.
On peut alors déterminer la vitesse limite de décantation VH d'une particule : 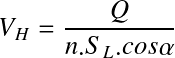
Exemple : Différents types de décanteurs lamellaires
On pourra distinguer notamment :
fonctionnement à contre courant
fonctionnement à courant parallèle
fonctionnement à courant croisé
Exercice
Votre décanteur comprend 7 lamelles inclinées.
Calculez la surface totale de décantation disponible incluant les lamelles et la surface au miroir.
En déduire la vitesse de Hazen appliquée à votre décanteur. Quelle est sa proportion par rapport à la vitesse ascensionnelle ?
Quel est alors l'intérêt d'un décanteur lamellaire ?
Coagulation et floculation
Pourquoi utiliser un coagulant ?
Les méthodes de séparation par décantation, flottation ou filtration concernent plus particulièrement la partie solide de la phase en suspension, à condition que ses éléments constitutifs soient d'une taille assez grande.
Pour ce qui est des particules très fines ou des matières colloïdales, les méthodes physiques ou mécaniques de séparation sont très rapidement inefficaces (voir tableau ci-dessous).
Il faut alors faire appel à des agents chimiques, les coagulants, qui provoquent la coalescence des très fines particules en suspension et l'amorce de la formation d'un floc d'une taille suffisante pour que son élimination par décantation ou filtration soit aisée.
Diamètre de la particule (mm) | Matière en Suspension | Temps de décantation pour 1 m (ordre de grandeur) |
|---|---|---|
10 | Gravier | 1 seconde |
1 | Sable | 10 secondes |
0,1 | Sable fin | 2 minutes |
0,01 | Argile | 2 heures |
0,001 | Bactérie | 8 jours |
0,0001 | Particule colloïdale | 2 ans |
0,00001 | Particule colloïdale | 20 ans |
Mécanismes de la coagulation-floculation
Déstabilisation d'une suspension colloïdale
Pour permettre la séparation d'une suspension colloïdale dans des conditions de vitesse satisfaisantes, il est nécessaire de rassembler les colloïdes pour constituer des particules nettement plus importantes.
Il faut donc transformer la suspension par des moyens artificiels. Cette transformation est la résultante de deux actions différentes :
une déstabilisation s'effectuant le plus souvent par addition de réactifs chimiques qui, par des mécanismes d'agrégation ou d'adsorption, annulent les forces répulsives ou agissent sur l'hydrophilie des particules colloïdales ;
une agglomération des colloïdes "déchargés" : elle résulte de diverses forces d'attraction entre particules mises en contact, d'abord par mouvement brownien jusqu'à l'obtention d'une grosseur de 0,1 micron environ, puis par agitation mécanique extérieure amenant les flocons à une taille suffisante.
Il est d'usage chez les traiteurs d'eau de réserver le terme "coagulation" au phénomène de déstabilisation et celui de "floculation" à l'agglomération des colloïdes déchargés. Les réactifs correspondants sont appelés respectivement coagulants et floculants.
Coagulation
Produits utilisés
L'action coagulante d'un élément chimique est fonction de la valence de l'ion qui porte une charge opposée à celle des particules en suspension. La coagulation est d'autant plus efficace que la valence de l'ion considéré est plus élevée.
C'est ainsi que les sels de fer et d'aluminium trivalents sont très employés. Cependant, par suite de l'hydrolyse qu'ils produisent, ils modifient les caractéristiques physico-chimiques de l'eau traitée (pH, conductivité).
Ce sont principalement le sulfate d'aluminium, Al2(SO4)3, et le chlorure ferrique (FeCl3). Sont aussi utilisés le sulfate ferreux et le sulfate ferrique, ainsi que des polymères d'aluminium (n'affectant que peu le pH de l'eau traitée).
L'action coagulante de ces sels résulte de l'hydrolyse qui suit leur dissolution, laquelle ne conduit pas immédiatement à la formation de l'hydroxyde correspondant (exemple : Fe(OH)3, Al(OH)3). Les composés intermédiaires (par exemple, les complexes hydroxo-alumineux pour l'aluminium) apportent les charges nécessaires à la neutralisation des colloïdes et seraient susceptibles, selon certains auteurs, de se polymériser et de créer ainsi des ponts entre les colloïdes, amorçant le processus de floculation.
Le pH joue un rôle très important dans l'étude des phénomènes de coagulation-floculation et en général il est préférable de se trouver à un pH situé dans la zone correspondant au minimum de solubilité des ions métalliques du coagulant utilisé.
Pour les sels d'aluminium, c'est à un pH compris entre 6 et 7,4 que le minimum d'ions Al3+ reste en solution : en-dehors de cette zone, et suivant la minéralisation de l'eau, on risque de retrouver une proportion plus ou moins forte d'aluminium en solution.
Dans certains cas exceptionnels, l'eau à traiter contient une grande quantité de matières riches en composés aluminiques ; un simple accroissement du pH provoque la coagulation de ces composés.
La zone de pH est beaucoup plus étendue pour les sels de fer ; le minimum de solubilité est atteint dès que le pH est supérieur à 5.
Le pH sera ajusté à l'aide de chaux, de soude ou de carbonate de sodium.
Fondamental : Réaction mise en œuvre
L'ajout du coagulant occasionne la formation d'hydroxydes métalliques qui vont rapidement précipiter avec la consommation d'alcalinité en parallèle (diminution du TAC et du pH). Par exemple, avec le chlorure ferrique, la réaction s'écrit :
![]()
La réaction précédente libère donc de l'acidité qui pourra être neutralisée par l'alcalinité présente dans l'eau à traiter. Ainsi, 1 degré français de chlorure ferrique consomme 1 degré français de TAC ! Si cette neutralisation "naturelle" est insuffisante pour arriver à un pH optimal , il sera nécessaire d'ajouter selon les cas soit une base forte (chaux ou soude) ou un acide (acide sulfurique ou CO2).
Les mécanismes de coagulation des colloïdes seront alors de deux ordres selon le pH :
pH proche de la neutralité : piégeage dans le précipité (le potentiel zeta reste négatif) ;
pH légèrement acide (5 à 6) : neutralisation de la charge primaire des colloïdes (potentiel zeta nul dans les conditions optimales).
Floculation
La floculation est l'opération permettant l'agglomération des particules déstabilisées par coagulation (Legube, 2015). La vitesse d'agglomération des particules sous agitation lente dépend principalement :
de l'efficacité de la coagulation précédente ;
de la concentration en particules ;
du gradient de vitesse (G) du mélangeur.
De plus en plus souvent, des polymères sont ajoutés au niveau de l'étape de floculation. On appelle ces réactifs des "floculants" bien qu'ils essentiellement une action de coagulation. Les mécanismes induits sont la neutralisation de la charge primaire et/ou l'adsorption suivie d'une floculation par pontage inter-particulaire des particules coagulées.
Parmi les floculants employés en complément des coagulants, on distingue :
les floculants d'origine minérale naturelle (silice activée)
les floculants d'origine organique naturelle (amidon, alginates)
les floculants de synthèse (polymères de masse molaire élevée, appelés polyélectrolytes).
Les floculants
La silice activée
Elle est constituée d'une solution d'acide polysilicique, (H2,SiO3)4, provenant de la polymérisation contrôlée de l'acide silicique. Elle est peu stable mais reste très employée dans la production d'eau potable.
Les polymères organiques
Ce sont des macromolécules à longue chaîne, d'origine naturelle (amidon, alginates) ou obtenus par association de monomères synthétiques, certains possédant des charges électriques ou des groupements ionisables.
Les polymères naturels ont une efficacité relativement faible, à l'encontre des polymères synthétiques qui ont des performances remarquables.
Selon le caractère ionique de leur groupement actif, les polymères synthétiques, aussi appelés polyélectrolytes, sont classés en :
polyélectrolytes non ioniques : principalement des polyacrylamides de masse molaire comprise entre 1 et 30 millions de grammes ;
polyélectrolytes anioniques : de masse molaire de quelques millions de grammes, ils sont caractérisés par la coexistence de groupements permettant l'adsorption et de groupements ionisés négativement (groupements carboxyliques ou sulfuriques), dont le rôle est de provoquer l'extension du polymère. Le plus connu est un polyacrylamide partiellement hydrolysé par la soude ;
polyélectrolytes cationiques : ils portent sur leurs chaînes une charge électrique positive, due à la présence de groupements amine, imine ou ammonium IV. Certains d'entre eux, de masse molaire relativement faible, et très chargés en charges positives, sont susceptibles de neutraliser les charges négatives des colloïdes et d'annuler leur potentiel Zêta, agissant ainsi comme un coagulant.
L'emploi de floculant permet, le plus souvent, d'une part de limiter l'emploi de coagulant, d'autre part de parfaire le traitement de coagulation-floculation.
Stabilité des suspensions colloïdales
Les suspensions colloïdales sont composées de micro-particules englobant un important volume d'eau liée et caractérisées par une masse volumique réduite.
Leur très grande stabilité dans l'eau est le résultat d'une solvatation ou d'une action protectrice due à certains corps adsorbés, ainsi que de la présence à leur surface d'une charge électrique qui a une action répulsive prépondérante par création de forces répulsives interparticulaires (ces charges sont toujours négatives pour les eaux naturelles, en majorité négatives pour les eaux usées).
Cette charge superficielle des particules colloïdales, qui peut être mise en évidence au microscope par déplacement sous l'action d'un champ électrique, est caractérisée par un potentiel, appelé potentiel Zêta (pZ), qui représente la différence de potentiel entre la surface des microparticules et la masse du liquide solvant.
On modélise les charges de surface de ces micro-particules selon le modèle de la double-couche de Stern. Les charges négatives de surface attirent des "contre-ions" positifs de manière plus ou moins importante en fonction de l'éloignement de la particule. On a ainsi une répartition en deux couches :
1 couche liée (dite de Stern ou de Helmholtz) : fixe
1 couche diffuse (dite de Gouy-Chapman) : déformable et mobile
Ces charges occasionnent une différence de potentiel :
Potentiel thermodynamique total entre la surface de la particule et le milieu ambiant : Nernst
Potentiel « pratique » mesurable à la surface de la couche liée : potentiel Zeta ζ (pZ)
Le potentiel Zeta est fonction du potentiel de Nernst et de l'épaisseur de la double-couche.
Mise en œuvre de la coagulation-floculation
La coagulation et la floculation sont mises en œuvre séparément et de manière consécutive, que ce soit au laboratoire ou au sein des filières. La coagulation consiste donc à introduire les réactifs dans l'eau à traiter, sous agitation rapide pour commencer à formes les flocs.La floculation subséquente a alors pour but de faire grossir ces flocs initiaux, avec une vitesse d'agitation plus lente.
Pour la mise en œuvre des étapes de coagulation et floculation il faut ainsi mettre en place deux réacteurs agités, caractérisés par des temps de séjours et des énergies de brassage mise en œuvre différentes. En effet la coagulation nécessite une homogénéisation rapide et une bonne mise en contact de l'eau à traiter et des réactifs. Le temps de séjours peut alors être assez court, avec une énergie de brassage importante. A l'inverse la formation des flocs nécessite un brassage pas trop énergique de manière à ne pas casser le floc, et un temps de formation des flocs plus important.
Les paramètres de conception des réacteurs utilisés sont présentés ci-après :
Coagulation
Temps de coagulation très court (de l'ordre de la seconde) : le temps de séjour hydraulique appliqué est de l'ordre de 20 à 180 secondes.
Utilisation optimale du coagulant : neutralisation des colloïdes totale et homogène avant la précipitation (hydroxydes)
Nécessité de diffusion quasi-instantanée du coagulant dans l'eau brute
Dans un mélangeur : Conditions d'un RPA !
Temps de séjour hydraulique : quelques minutes
Injection du coagulant et des réactifs d'ajustement du pH par pompes doseuses
Gradient de vitesse : 500 à 1000 s-1
Floculation
Temps de séjour hydraulique : 15 à 30 minutes
Gradient de vitesse : 30 à 60 s-1
Gradient de vitesse
Définition :
Le gradient de vitesse est un paramètre hydrodynamique déterminant pour l’efficacité des opérations de coagulation et floculation. II est défini comme la fifférence de vitesse entre deux veines fluides adjacentes dans un plan orthogonal à leur déplacement
Il a été défini primitivement en régime laminaire puis généralisé. Pour un réacteur mélangé, son expression est la suivante :
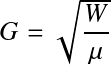
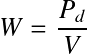
![]()
avec :
W : énergie moyenne dissipée par unité de volume (kg/m/s3)
Mu = viscosité dynamique (kg/m/s)
G : gradient de vitesse (s-1)
Pd : puissance dissipée (kg.m2/s3)
V = volume du réacteur (m3)
CD : coefficient de traînée (dépend de la forme de la pâle par exemple 1,8 pour des pâles plates)
A : surface pâle (m2)
ρ : masse volumique (kg/m3) : attention : 1 peu plus de 1 (1,011) pour eau floculée
n : vitesse relative de la pâle par rapport au liquide (m/s)
Protocoles jar-test et mise en route du pilote
Introduction
Ce protocole est celui que vous auriez du suivre en TP. Bien évidemment, vous ne pourrez pas effectuer les manipulations proposées. Cependant, je vous donne ici un jeu de données tel que vous auriez pu l'obtenir en séance. Les données brutes pour votre interprétation sont sur ce fichier :
Fichier à télécharger
Choix des réactifs, de leur dose et du pH optimal : expérience du jar-test
Une fois le choix du coagulant réalisé suite à des essais et connaissant les caractéristiques des eaux à traiter (minéralisation, concentration en matière organique naturelle dissoute), il est nécessaire de choisir la dose à injecter ainsi que le pH optimal de coagulation. Cependant, les mécanismes en œuvre sont d'un complexité telle que les notions théoriques de la coagulation-floculation seules ne permettent pas de préciser les conditions optimales de traitement à appliquer pour une eau donnée. L'expérience dite du jar-test est alors nécessaire. Ce type d'expérience est fréquemment réalisée en usine d'eau potable.
Cette étude comporte 4 phases successives :
caractérisation de l'eau brute : nous nous limiterons ici à la turbidité et au pH
recherche du pH optimal de coagulation-floculation, à une concentration fixe de coagulant, par ajout d'eau de chaux à 4 g/L de Ca(OH)2.
recherche préliminaire de la concentration de traitement en coagulant FeCl3.
caractérisation de l'eau traitée après choix du pH optimal.
L'ajout de coagulant (FeCl3,6 H2O ), provoquant la formation d'acide, FeCl3 + 3 H2O => Fe(OH)3 + 3 HCl, il est nécessaire de rétablir un pH convenable par adjonction d'une base, ici de l'eau de chaux à 4 g/l Ca(OH)2.
Habituellement, les teneurs des solutions de chlorure ferrique utilisées se situent entre 5 et 150 mg/l en FeCl3. Les teneurs des solutions de chaux sont comprises entre 10 et 200 mg/l en Ca(OH)2 (il s'agit des concentrations de travail ou de traitement).
Méthode : Choix de la dose optimale : manipulation à effectuer
déterminer sur l'eau brute non filtrée, le pH sous agitation lente, la turbidité ;
remplir chacun des 6 béchers du floculateur de 500 ml d'eau brute, prélevés à l'éprouvette graduée.
ajouter dans les béchers les doses de réactifs suivantes (exprimées en mL du réactif considéré pour 500 mL d'eau brute à traiter) :
Bécher n° | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
Ca(OH)2 à 4 g/L | 0 | 2,6 | 5,2 | 7,8 | 10,4 | 13 |
FeCl3.6H2O à 5 g/L | 0 | 5 | 10 | 15 | 20 | 25 |
mise en route du floculateur (vitesse lente puis rapide 150 t/mn).
on maintient 150 t/mn durant 4 mn puis passage à une vitesse lente de 40 t/min durant 15 min (observation de l'aspect du floc : grosseur et quantité).
arrêt de l'agitation
noter le temps de décantation en minutes pour chaque bécher, en considérant les flocs de vitesse moyenne ou estimer l'aptitude à la décantation du floc (vitesse). Laisser décanter 15 min maximum (fin de l'observation).
après la décantation (15 min maximum), transvaser environ 100 ml de surnageant, en évitant de remettre en suspension le décantat, puis mesurer la turbidité.
Critères de choix de la concentration en coagulant FeCl3 :
la coagulation : les flocs doivent être suffisamment gros, denses et nombreux pour décanter rapidement (au delà de 10 mn, la décantation est trop lente).
On recherchera une couleur et une turbidité minimales ainsi qu'un floc présentant une bonne aptitude à la décantation.
l'aspect du surnageant : de préférence limpide, incolore et sans trop d'éléments flottants.
Mesurer le pH sous agitation pour les différents béchers.
Remarque :
Ici, vous n'avez pas fait varier le pH. On devrait en théorie réaliser un autre test avec une dose de FeCL3 fixe et un pH variable pour déterminer le pH optimal. L'idéal est de réaliser au minimum le test avec 6 doses vs 6 pH soit 6 expériences pour un banc de jar-test comprenant 6 postes.
Pour la suite du TP, on supposera le pH optimal égal à 5,8.
Méthode : Détermination des doses optimales de réactifs
Relations issues de modèles difficilement exploitables
Utilisation de tests au laboratoire => jar-tests
Détermination du réactif optimal
Détermination de la dose optimale
Détermination du pH optimal
On mesure habituellement :
Observation visuelle
Turbidité surnageant
Absorbance
Potentiel zeta
Caractéristiques des boues (pourcentage formé, vitesse de sédimentation)
Ici, vous mesurerez uniquement la turbidité, le pH et réaliserez une observation visuelle.
TP 3 (b) : transposition des résultats de jar-test sur le pilote de traitement
Objectifs
L'objectif de cette activité est la transposition des résultats des essais réalisés en batch (jar-test) au laboratoire à l'échelle d'un pilote de traitement fonctionnant en continu. A l'issue de cette activité, vous serez en mesure de :
Dimensionner les réacteurs de coagulation et floculation : ici, pour un volume donné, il s'agira de calculer le débit d'eau brute pouvant être traité sur l'installation ;
Calculer les débits d'injection des réactifs en fonction du taux de traitement souhaité et des caractéristiques des solutions commerciales utilisées.
Vous mettrez alors en route l'installation !
Introduction
Le pilote comprend :
un réacteur de coagulation de 5 litres ;
un réacteur de floculation de 40 litres ;
un décanteur lamellaire de 100 litres comprenant 7 lamelles.
Exercice : Dimensionnement des réacteurs et de l'injection des réactifs
Nous considérerons des temps de séjour hydrauliques de 2 min et 16 min respectivement pour la coagulation et la floculation.
Dans ces conditions, quel débit peut être traité sur notre installation pilote ?
Vous connaissez la dose de chlorure ferrique à injecter exprimée en mg FeCl3 pur / L d'eau traitée (voir manipulation précédente).
Vu que la solution commerciale disponible dans le bidon alimentant le pilote est à 3 g/L de FeCl3.6H2O alors que celle utilisée pour le jar-test était de 5 g/L, déterminez le débit de ce réactif à injecter pour respecter la dose prescrite.
Mettre en route la pompe d'alimentation et la pompe doseuse du réactif au débit choisi. Mettre en route la régulation de pH. Observer les phénomènes.
Conclusion
Bravo ! Vous avez réalisé votre première mise en route d'installation de traitement ! Nous allons maintenant nous intéresser au fonctionnement et au dimensionnement du décanteur.
Filtration
Introduction
La filtration est un procédé physique destiné à clarifier un liquide qui contient des matières solides en suspension en le faisant passer à travers un milieu poreux. Les solides en suspension ainsi retenus par le milieu poreux s'y accumulent en surface et dans la masse filtrante.
Il faut donc nettoyer ce milieu de façon régulière. Un filtre aura donc des cycles de filtration d'autant plus longs que les traitements préalables auront été efficaces.
Les applications de la filtration sont très diverses, tant en traitement des eaux usées, qu'en traitement des eaux destinées à la consommation humaine :
Eau potable | Eau usée | Traitement des boues |
|---|---|---|
Clarification après coagulation/floculation/décantation | Filtration membranaire en remplacement d'un décanteur | Filtres-presses |
Déferrisation/démanganisation | Traitements biologiques sur support (culture fixée) | Filtres à bande |
Nitrification/dénitrification | Traitement tertiaire | Tambours rotatifs |
Adsorption | ||
Filtres pour reminéralisation/neutralisation d'eaux agressives (calcaire...) | ||
Filtration membranaire |
Dans le cadre de cet enseignement, nous aborderons essentiellement la filtration dans la masse (milieu poreux formé de sable) d'une eau chargée en particules dans l'objectif de réduire sa turbidité et sa teneur en MES (application pour le traitement d'eau potable).
Généralités
Définition :
La filtration est une opération unitaire qui consiste à séparer une phase continue d'une phase dispersée en retenant la phase dispersée par un support ou une masse poreuse.
Les différents procédés de filtration se distinguent suivant qu'il s'agisse :
d'une filtration dans la masse ou d'une filtration sur support
d'une filtration continue ou d'une filtration discontinue
d'une filtration à débit constant ou d'une filtration à pression
constante
d'une filtration frontale ou d'une filtration tangentielle
Fondamental : Filtration dans la masse ou sur support
Filtration dans la masse : La suspension s'écoule au travers d'une masse poreuse qui se colmate en donnant un filtrat appauvri en phase dispersée. Au fur et à mesure de la filtration, on retient des particules dans le milieu poreux et la porosité diminue. |
Filtration sur support : Les particules vont se déposer sur le support et former un gâteau d'épaisseur croissante. |
Fondamental : Filtration continue ou discontinue
Filtration continue : un support de gâteau (ou masse filtrante) se déplace lentement devant la suspension. Lorsque le gâteau est suffisamment épais (ou que le colmatage de la masse est assez important), on procède à l'enlèvement du gâteau (ou au décolmatage de la masse ou même à son remplacement si ce décolmatage est impossible ou non rentable) avec, le cas échéant, des étapes intermédiaires de lavage et essorage du gâteau.
Ex.: Filtres rotatifs à tambour
Filtration discontinue : on amène la suspension dans une capacité munie d'un support de gâteau (ou d'une masse poreuse). On arrête l'opération lorsque la capacité est remplie (ou lorsque le colmatage de la masse atteint le maximum tolérable). Il faut démonter le filtre, extraire le gâteau (ou décolmater, ou remplacer la masse filtrante) et remonter l'ensemble pour recommencer un nouveau cycle.
Ex.: Filtres presses
Les filtres discontinus sont parfois équipés de systèmes plus ou moins automatiques destinés à supprimer ou réduire l'intervention humaine en fin de cycle.
Fondamental : Filtration à débit et pression constants ou variables
Filtration à débit constant : le débit de filtration est maintenu constant tout au long de la filtration. La perte de charge au travers du milieu augmente au cours de la filtration traduisant le colmatage progressif du milieu.
Filtration à pression constante : la perte de charge (ou la différence de pression) appliquée au système est maintenue constante tout au long de la filtration. Le débit diminue au cours du temps traduisant le
colmatage progressif du milieu.
Fondamental : Filtration frontale ou tangentielle
Filtration frontale
L'écoulement du fluide est perpendiculaire à la section d'ouverture du milieu. La résistance à l'écoulement augmente tout au long de la filtration.
Filtration tangentielle
Lors d'une filtration sur support, l'écoulement du fluide peut être tangentiel au support. Les particules sont alors soumises aux forces de pression mais également aux forces de cisaillement qui limitent l'épaisseur du gâteau. On peut ainsi travailler, en théorie, à pression et débit constant.
Filtration dans la masse
Introduction
Une vidéo présentant le fonctionnement d'un filtre à sable est disponible ici :
Types de filtres
Les filtres utilisés, notamment en traitement d'eau potable (clarification) peuvent être classifiés selon différents critères :
Définition : Mode d'alimentation
Filtres ouverts : la circulation de l'eau s'effectue gravitairement |
Filtres fermés : la circulation de l'eau se fait sous pression (ligne de charge maintenue). Ils sont réalisés dans des cuves métalliques, ce qui limite leur diamètre et donc leur utilisation à de relativement petits débits. Par ailleurs, ils sont plus onéreux que les filtres ouverts et ne sont utilisés que lorsque les conditions locales en rendent l'emploi particulièrement intéressant, notamment lorsqu'il s'agit de clarifier une eau peu chargée à l'aval d'une station de pompage. |
Selon le matériau de filtration
On distingue principalement les applications suivantes :
Filtre à sable | Élimination de la turbidité, des MES, déferrisation, démanganisation |
|---|---|
Filtre bi-couche | Adapté à des eaux chargées et colmatantes |
Filtres à calcaire | Neutralisation d'eaux agressives (et réduction de la turbidité en sus) |
Filtres à CAG | Adsorption de pesticides, de la matière organique |
Filtres biologiques (supports variés) | Élimination de la matière organique, nitrification, dénitrification, déferrisation, démanganisation... |
Caractéristiques du milieu poreux
Granulométrie
Elle se caractérise par une courbe représentant le pourcentage massique des grains passant au travers de mailles d'une succession de tamis normalisés. Elle permet notamment de déterminer la taille effective et le coefficient d'uniformité.
Définition : Taille effective
La TE10 correspond à la maille laissant passer 10% des grains et donc en retenant 90% : ces 90% en masse ont donc une taille supérieure à la taille effective.
Définition : Coefficient d'uniformité
Le CU est égal au rapport des tailles correspondant aux pourcentages 60 et 10 de la courbe granulométrique et détermine l'homogénéité de la taille des grains.
Remarque :
Le risque de colmatage du filtre augmente en présence de particules fines. Au moment du lavage, ces fines vont se placer entre les éléments les plus gros, colmatant ainsi les espaces disponibles pour la circulation de l'eau. La TE10 ne doit donc être ni trop faible (risque accru du colmatage) ni trop grande sinon l'eau est mal filtrée.
Attention :
Taille effective et coefficient d'uniformité optimum dépendent de l'application envisagée !
Définition : Porosité
La porosité, notée ε, est égale au rapport entre le volume de vide et le volume total (vide + sable). Elle définit la section de passage des particules au travers du matériau.
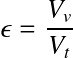
avec :
Vv = volume de vide
Vt = volume total
Définition : Masse volumique apparente et réelle
La masse volumique apparente est celle du matériau non tassé. La densité réelle est celle du matériau tassé. On peut alors écrire :
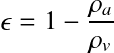
avec :
ρa = masse volumique apparente
ρv = masse volumique réelle
Filtration dans la masse d'une suspension chargée
La filtration des suspensions très peu chargées (rapport massique solide sur liquide inférieur au millième) en particules de dimensions inférieures à celles des pores du milieu filtrant, ne se fait pas
par formation d'un gâteau sur le milieu poreux, mais par dépôt dans la masse du filtre.
La concentration de la suspension diminue progressivement de l'entrée à la sortie du filtre. Les particules retenues s'accumulent dans les diverses couches du filtre et provoquent l'augmentation de la perte de charge et une diminution de la capacité d'élimination du lit poreux.
Mécanismes de capture
Les mécanismes de capture des particules par un filtre incluent :
Tamisage mécanique
Particules plus grosses que la maille du filtre
Dépôt sur le matériau filtrant
Interception par frottement
Diffusion (mouvement brownien)
Action de forces moléculaires (Van der Waals)
Action de forces physico-chimiques (potentiel Zeta)
Décantation
Qualité de l'eau après filtration
Les principaux paramètres suivis en sortie d'un filtre sont : turbidité, couleur, MES. Une eau filtrée de bonne qualité présente les caractéristiques suivantes :
Turbidité : 0,2 à 1,0 NFU (le plus souvent, on vise < 0,5 NFU)
MES : 0,05 à 0,2 mg/L
Le suivi de la turbidité pendant un cycle de filtration comprend les phases suivantes :
Effets de lavage (1,2 et 3) : la turbidité est importante et présente pendant les 10 premières minutes des variations liées à la présence dans le filtre d'eau de lavage (cas d'un lavage insuffisant).
Maturation (4) : la turbidité diminue, le filtre se met en équilibre. Cette séquence dure une dizaine de minutes.
Filtration : la turbidité reste faible et stable pendant plusieurs heures : la durée du cycle est liée à la quantité de matières à retenir.
Crevaison (5) : la capacité maximale de rétention du filtre est atteinte, la turbidité se met à augmenter. Il faut alors laver le filtre avant de démarrer un nouveau cycle.
Évolution des pertes de charge
L'accumulation des dépôts sur les grains de sable provque une diminution du volume des pores et une augmentation de la résistance à l'écoulement. Le colmatage du filtre correspond à un accroissement de la perte de charge au cours du temps.
Un filtre propre crée une perte de charge, même si l'eau qui le traverse est exempte de MES. Pendant la filtration, il y a accumulation de particules sur les grains et colmatage :
la surface spécifique des grains augmente ;
la porosité du filtre diminue à partir de la valeur initiale ε0 :
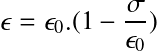 avec
avec 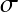 = volume de dépôt par unité de volume du filtre.
= volume de dépôt par unité de volume du filtre.
La surface des grains encrassée par unité de volume tend à augmenter de manière plus importante dans les couches supérieures du filtre : la perte de charge par unité de hauteur ne sera donc pas identique sur toute sa hauteur.
Le fonctionnement optimal d'un filtre est atteint lorsque le temps t2 pour lequel le filtre atteint sa perte de charge maximale autorisée (liée aux dispositions constructives) est égal au temps t1 où la qualité du filtrat se détériore. On peut jouer sur les paramètres suivants :
volume de boues : lié à la qualité d'eau à traiter (une filtration est rarement conduite sans décantation préalable) ;
cohésion de la boues : peut être modifié par ajout d'un coagulant ;
taille effective et coefficient d'uniformité du média filtrant ;
hauteur du matériau ;
vitesse de filtration : elle représente le ratio du débit de filtration sur la surface de filtration (m3.m-2.h-1 ou m.h-1).
On parle de filtres lents lorsque la vitesse de filtration est de l'ordre de quelques m.j-1 et de filtres rapides lorsque la vitesse de filtration est de l'ordre de quelques m.h-1 (couramment 7 m.h-1)
Lavage du filtre
Le lavage des filtres est nécessaire pour décolmater le filtre. Il permet de retirer les matières retenues durant le cycle de filtration et de lui redonner ses caractéristiques hydrauliques initiales.
Modes de lavage
Il existe deux grands types de lavages :
lavage à l'eau seule : l'eau circule de bas en haut avec une vitesse suffisante pour mettre le sable en expansion ;
lavage air + eau : en plus d'une circulation ascendante d'eau, la masse de sable est soumise à une vibration provoquée par l'injection de bulles d'air. Cela permet le décollage des impuretés et leur entraînement avec l'eau de lavage. L'expansion est beaucoup moins importantes, ce qui permet des économies d'eau et de matériau (moins de perte).
La durée de lavage dépend de la qualité d'eau à traiter, de la nature des particules, du type de lavage utilisé, etc. Un cycle complet de lavage dure entre 8 et 15 minutes environ. Un filtre est nettoyé toutes les 12 à 24h.
Fondamental :
Lors du lavage, il y a expansion (fluidisation) du média filtrant soit une séparation des particules (augmentation de la porosité du lit).
Les petites particules initialement retenues ayant une vitesse terminale de chute libre inférieure sont emportées avec les eaux sales.
Ainsi, pour le lavage, la vitesse ascendante de l'eau doit être :
supérieure à la vitesse minimale de fluidisation du média filtrant (umf) ;
inférieure à la vitesse terminale du média filtrant (uf) pour éviter le transport du matériau hors du lit ;
supérieure à celle des particules retenues dans le filtre.
Expérimentalement, il a été démontré que la vitesse ascendante doit être égale à environ 10% de la vitesse de sédimentation du média filtrant.
Attention :
Le design est typiquement fait pour une température de l'eau de 20°C. Les propriétés de l'eau changeant en fonction de la température, il est impératif de corriger.
Exercice : Dimensionnement d'une batterie de filtres à sable
On souhaite dimensionner une étape de filtration sur sable prenant place après une étape de coagulation/floculation/décantation. L'eau à filtrer a une concentration en MES de 5 mg/L. La concentration en sortie du filtre sera de 0,2 mg/L. Le débit à produire est de 500 m3/h
Considérant une vitesse de filtration de 7 m.h-1, calculer la surface de filtration nécessaire.
Afin d'assurer une continuité de production, on opte pour une batterie de 7 filtres. Calculer la surface unitaire de chaque filtre dans cette configuration.
Pendant qu'un des 7 filtres est en cours de lavage, la production ne se fait que sur 6 filtres. La surface totale de filtration réelle est donc réduite. Reconsidérez le dimensionnement précédent en prenant en compte ce mode de fonctionnement.
Chaque filtre sera lavé toutes les 24h. Le cycle de lavage choisi comprend 12 minutes de lavage à l'eau avec une vitesse de 20 m.h-1. Calculer la perte en eau générée sur une journée exprimée en m3.j-1 et en %.
Adsorption
Introduction
L'adsorption est le phénomène par lequel certaines molécules de la solution peuvent se fixer sur la surface d'un solide sous l'effet des forces d'attraction intermoléculaires, sans qu'il y ait réaction chimique. L'adsorption constitue un phénomène de surface : elle correspond à la fixation à la surface d'un matériau (adsorbant) d'une substance liquide ou gazeuse (adsorbat).
Ce phénomène physique est mis en jeu en traitement des eaux pour éliminer de l'eau certains composés dissous, la plupart du temps non biodégradables, comme certains micropolluants : pesticides, THM, résidus médicamenteux... Ces opérations unitaires mettent en jeu la plupart du temps un matériau adsorbant de type charbon actif, soit en poudre (CAP), soit en grain (CAG). Dans le premier cas, l'adsorption est réalisée au sein de réacteurs agités (souvent en parallèle d'une coagulation) avant une étape de séparation. Dans le second cas, ce sont des filtres à CAG qui sont mis en œuvre.
L'adsorption est couramment employée en tant que traitement d'affinage sur les filières de potabilisation. Elle vise alors une amélioration des qualités organoleptiques de l'eau (goût, couleur), une élimination complémentaire de la matière organique et surtout un abattement des micropolluants non-dégradables par voie biologique ou oxydation chimique, les pesticides notamment. En eau usée, elle est une des technologies les plus utilisées dans l'optique d'un traitement tertiaire des micropolluants.
Principe de l'adsorption
Définition :
Le transfert d'un composé soluble depuis la phase liquide vers une interface solide est appelé adsorption. La substance qui est transférée est appelée adsorbat tandis que le solide sur lequel l'adsorbat vient se fixer est appelé adsorbant.
Le phénomène d'adsorption est lié à différents mécanismes d'interactions entre la surface de l'adsorbant et l'adsorbat. Ces mécanismes sont soit de nature physique (forces de Van der Waals, etc.) ou chimiques (formation de liaisons covalentes, complexation de surface, etc.).
Dans le domaine du traitement des eaux, il est souvent difficile de distinguer la chimisorption de la physisorption. Aussi, le simple terme de sorption est souvent utilisé pour désigner la rétention d'un composé soluble sur une surface.
Le processus d'adsorption se décompose en quatre étapes :
Transport de l'adsorbat au sein du liquide (par advection et diffusion) ;
Transfert de molécules vers la phase externe de la particule d'adsorbant ;
Diffusion de l'adsorbat au sein des macropores de l'adsorbant vers les sites d'adsorption situé dans les micropores sous l'effet du gradient de concentration ;
Adsorption proprement dite.
C'est la deuxième étape qui est déterminante dans les vitesses d'adsorption. L'adsorption dans les macropores est rapide et celle dans les micropores lente.
La cinétique d'adsorption
Définition :
Il s'agit de caractériser la quantité d'adsorbat retenu sur l'adsorbant en fonction du temps. La cinétique d'adsorption est donc définie par la fonction q = f(t) avec q = quantité d'adsorbat retenue (mol ou g d'adsorbat par g d'adsorbant). On peut alors déterminer le temps de contact requis pour atteindre l'équilibre d'adsorption (q = f(t) = constante).
Caractérisation des cinétiques d'adsorption
Plusieurs équations sont en mesure de décrire les vitesses d'adsorption. On peut notamment citer les cinétiques de pseudo-premier ordre et pseudo-second ordre établies respectivement par Lagergren et Ho et McKay (1998):
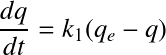
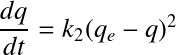
avec :
q = concentration d'adsorbat en phase solide au temps t (mol ou g d'adsorbat par g d'adsorbant) ;
qe = concentration d'adsorbat en phase solide à l'équilibre (mol ou g d'adsorbat par g d'adsorbant) ;
k1 = constante cinétique de pseudo-premier ordre (min-1) ;
k2 = constante cinétique de pseudo-second ordre (g adsorbant/(g adsorbat.min)) ;
Isothermes d'adsorption
L'isotherme d'adsorption
Définition :
La quantité de matière adsorbée sur l'adsorbant en fonction de la concentration de l'adsorbat en solution est déterminée à l'équilibre (temps de contact minimum défini par la cinétique) et à température constante, au sein d'une série de réacteurs en batch contenant différentes concentrations initiales en adsorbat. A l'équilibre, on définit la quantité de matière adsorbée comme suit :
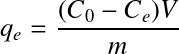
avec :
qe = concentration d'adsorbat en phase solide à l'équilibre (mol ou g d'adsorbat par g d'adsorbant) ;
C0 = concentration initiale d'adsorbat en phase liquide (mol ou g.m-3) ;
Ce = concentration d'adsorbat en phase liquide à l'équilibre (mol ou g.m-3) ;
V = volume de liquide dans le réacteur (m3) ;
m = masse d'adsorbant dans le réacteur (g) ;
La fonction qe = f(Ce) est appelée isotherme d'adsorption. Différents modèles existent dans la littérature pour décrire les isothermes d'adsorption : les plus courants sont les modèles de Langmuir et Freundlich.
Isotherme de Langmuir
Le modèle de Langmuir est un modèle mécaniste. Il est fondé sur des hypothèses réactionnelles entre le soluté (adsorbat) et l'adsorbant :
Le solide présente une capacité maximale d'adsorption Qmax , le nombre de sites d'adsorption est fini ;
Tous les sites d'adsorption à la surface du solide sont identiques ;
Chaque site d'adsorption retient une seule molécule d'un composé donné ;
Tous les sites sont énergétiquement et stériquement indépendants de la quantité de composé adsorbé ;
L'adsorption est un phénomène réversible.
La réaction suivante est alors considérée à la surface de l'adsorbant :
![]()
avec :
S = site d'adsorption libre
A = adsorbat
SA = complexe de surface site-adsorbat
La loi d'action de masse appliquée à cet équilibre (en considérant les coefficients d'activité égaux à 1) amène alors l'équation suivante :
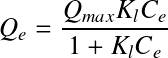
avec :
qe = concentration d'adsorbat en phase solide à l'équilibre (mol ou g d'adsorbat par g d'adsorbant) ;
Ce = concentration d'adsorbat en phase liquide à l'équilibre (mol ou g.m-3) ;
Qmax = capacité maximale d'adsorption (mol ou g d'adsorbat par g d'adsorbant) ;
Kl = constante d'affinité (m3.g-1) ;
L'isotherme atteint un plateau défini par la capacité maximale d'adsorption Qmax. La correspondance de points expérimentaux avec l'équation de Langmuir ne signifie pas nécessairement que les hypothèses définies ci-dessus sont valides pour le système étudié.
Méthode :
Les constantes de Langmuir peuvent être déterminées de manière aisée via une linéarisation de l'équation (déconseillé) ou préférentiellement par ajustement par régression non-linéaire avec minimisation d'une fonction d'erreur (utilisation du solveur de Microsoft Excel par exemple).
Isotherme de Freundlich
Ce modèle est un modèle empirique développé par Freundlich. Il est fondé sur la relation suivante entre Ce et Qe :
![]()
avec :
qe = concentration d'adsorbat en phase solide à l'équilibre (mol ou g d'adsorbat par g d'adsorbant) ;
Ce = concentration d'adsorbat en phase liquide à l'équilibre (mol ou g.m-3) ;
Kf = facteur de capacité de Freundlich (g.g-1 ou g.mol-1) ;
1/n = facteur d'intensité de Freundlich (sans unité).
Dans cette équation, l'isotherme ne présente pas de plateau lorsque Ce augmente.
Mise en œuvre du charbon actif à l'échelle industrielle
Au sein d'une filière de traitement des eaux, le traitement par adsorption peut se présenter sous deux formes principales :
Procédé d'adsorption sur Charbon Actif en Grains (CAG) : il s'agit d'un filtre dont le matériau poreux est constitué de charbon d'une granulométrie de quelques mm. La rétention de matières en suspension ainsi que le développement éventuel d'un biofilm bactérien rendent nécessaires des cycles de lavage par fluidisation du matériau.
Procédé d'adsorption sur Charbon Actif en Poudre (CAP) : il s'agit le plus souvent d'un réacteur agité (parfaitement ?) dit « Réacteur à CAP ». Le charbon utilisé est alors d'une granulométrie de quelques dizaines de microns. Il est nécessaire par la suite de le séparer par décantation. Ce type d'ouvrage est alors similaire à une étape de clarification par coagulation-floculation-décantation.
TP 5 : adsorption sur charbon actif en réacteurs fermés
Objectifs
Mettre en œuvre un test d'adsorption,
Déterminer les paramètres de modèles cinétiques d'adsorption à partir de données expérimentales,
Citer et exprimer les équations régissant l'équilibre d'adsorption (isothermes) et en déterminer les paramètres à partir de données expérimentales,
Dimensionner un filtre à charbon actif en grain.
Introduction
Un test d'adsorption se déroule toujours en deux temps :
l'étude cinétique permet de déterminer le temps de contact à respecter pour un rendement donné et le temps d'équilibre,
l'isotherme permet de définir l'équilibre d'adsorption et permettra de dimensionner la dose à injecter dans le procédé de traitement,
En salle TP, vous auriez eu à votre disposition :
une table d'agitation et des flacons en verre de 100 mL
du charbon actif en grains,
une solution mère de bleu de méthylène à 1 g/L,
de la verrerie,
un spectrophotomètre,
des cuvettes pour mesures au spectrophotomètre.
Cinétique d'adsorption
Méthode : Lancement de l'expérimentation
Introduire dans 10 erlenmeyers une dose identique de charbon actif à 150 mg,
Ajouter 50 mL d'eau distillée dans chacun des béchers,
Ajouter 1 mL de solution mère de bleu de méthylène, lancer le chronomètre dès la mise en contact entre le colorant et le charbon
Boucher les flacons,
Mettre la table d'agitation en route de manière à obtenir une agitation optimale.
Méthode : Étude de la cinétique d'adsorption
Vous prélèverez au cours du temps chacun des flacons (on parle d'échantillons "sacrificiels") pour séparer la solution de bleu de méthylène du charbon. Vous conserverez la solution correspondante à chaque temps dans un bécher séparé dûment identifié. Ne pas prélever de grains de charbon.
Les temps de prélèvement seront (en minutes) : 5,10,15,20,30,45,60,80,100,120.
Vous mesurerez au spectrophotomètre la concentration résiduelle en colorant pour chaque échantillon.
Vous tracerez le graphe représentant la quantité adsorbée (notée q(t) et exprimée en mg bleu de méthylène/g CAP) au cours du temps.
Isotherme d'adsorption
Méthode : Lancement de l'expérimentation (isothermes)
Introduire dans 6 flacons une dose croissante de charbon actif allant de 0 (témoin) à 300 mg,
Ajouter 50 mL d'eau distillée dans chacun des flacons,
Ajouter 1 mL de solution mère de bleu de méthylène,
Boucher les flacons,
Mettre la table d'agitation en route de manière à obtenir une agitation optimale.
Étude de l'isotherme d'adsorption
Lorsque le temps d'équilibre a été atteint (la concentration en solution ne varie plus au cours du temps), prélever un échantillon (sans prendre de grains) dans chaque flacons,
Analyser la concentration en solution à l'équilibre notée Ce au spectrophotomètre.
Vous tracerez le graphe représentant la quantité adsorbée à l'équilibre qe en fonction de la concentration mesurée en solution à l'équilibre Ce appelé isotherme d'adsorption (il s'agit en fait d'une courbe d'équilibre).
Dosage du bleu de méthylène
Méthode : Etalonnage
Le dosage s'effectue au spectrophotomètre à une longueur d'onde de 660 nm. Le principe fondamental est la loi de Beer-Lambert.
Pensez à faire le zéro du spectrophotomètre à l'eau déminéralisée.
Vous déterminerez la relation concentration = f(absorbance) en mesurant l'absorbance pour des concentrations connues en bleu de méthylène.
Dans une fiole jaugée de 50 mL, ajouter 2 mL de la solution à 1 g/L que vous avez à disposition et compléter à l'eau distillée. On appellera cette solution E1.
Le tableau ci-dessous vous donne les indications pour préparer les solutions étalons dans des fioles jaugées de 50 mL.
Volume solution E1 (mL) | 0 | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|---|
Volume d'eau distillée (compléter au trait de jauge) | 50 | 49 | 48 | 47 | 46 | 45 |
Concentration en bleu de méthylène (mg/L) | ||||||
Absorbance |
Vous tracerez la droite concentration=f(absorbance) dont la pente vous permettra de calculer les concentrations de vos échantillons.
Attention :
Pour la mesure de vos échantillons, si l'absorbance dépasse le domaine de linéarité et/ou votre gamme d'étalonnage, refaire la mesure en diluant l'échantillon ! ! !
Définition de la quantité d'adsorbat éliminé
Définition :
Pour chaque erlenmeyer, la quantité de la molécule ciblée adsorbée sur le matériau adsorbant est définie par :
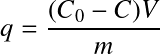
avec :
q = concentration d'adsorbat en phase solide (mol ou g d'adsorbat par g d'adsorbant) ;
C0 = concentration initiale d'adsorbat en phase liquide (mol ou g.m-3) ;
C = concentration d'adsorbat en phase liquide (mol ou g.m-3) ;
V = volume de liquide dans le réacteur (m3) ;
m = masse d'adsorbant dans le réacteur (g) ;
Données expérimentales
Les données expérimentales (étalonnage du spectrophotomètre, cinétiques, isothermes) sont disponibles dans le fichier suivant :
Exercice : Interprétation des cinétiques et des isothermes
Cinétiques
Vous ajusterez les données expérimentales aux différents modèles cinétiques proposés dans la suite du cours (pseudo-ordre 1 et pseudo-ordre 2). Vous intégrerez les deux équations proposées pour réaliser ensuite une régression non-linéaire utilisant le solveur (Microsoft Excel ou équivalent).
Lequel de ces deux modèles permet le mieux d'ajuster les données expérimentales ?
Quel est le temps d'équilibre ?
Isothermes
Sur le même principe, ajustez votre isotherme d'adsorption aux modèles de Langmuir et Freundlich.
Lequel de ces deux modèles permet le mieux d'ajuster les données expérimentales ? Quelle indication sur les mécanismes d'adsorption ?
Exercice : Traitement de pesticides par charbon actif
Une eau de forage prélevée à un débit de 60 m3.h-1 contient 2 µg.L-1 de Métazachlore. On veut réduire cette concentration à 0,01 µg.L-1 soit par adjonction de charbon actif en poudre (CAP) dans un réacteur parfaitement agité, soit par utilisation d'un filtre à charbon actif en grain (CAG) avec un temps de contact de 12 minutes.
Constantes de Freundlich du charbon actif utilisé :
Kf = 1,82 µg.mg-1.(L.µg-1)1/n
1/n = 0,13
Déterminer la dose de CAP à injecter pour atteindre cet objectif en g.m-3 et en kg.an-1
En supposant le réacteur parfaitement agité et un régime permanent, la concentration visée en sortie correspondra à la concentration à l'équilibre Ce. L'isotherme nous donne alors la masse de pesticide adsorbée par mg de CAP (qe).
Connaissant les charges en pesticides à l'entrée et en sortie, on en déduit la masse de pesticides à éliminer par unité de temps.
On déduit alors de la valeur de qe et de cette dernière masse la dose de charbon à injecter.
Déterminer la durée de vie du filtre à CAG ainsi que la quantité de CAG à renouveler. Donnée complémentaire : la densité apparente du CAG utilisé est de 450 kg.m-3.
Le temps de contact de 12 min nous donne le volume utile de CAG à mettre dans le filtre. Avec la densité apparente, on en déduit la masse de CAG installée.
Avec la dose calculée à l'exercice précédent exprimée en kg.an-1 et cette masse installée, on en déduit la durée de vie théorique du filtre au bout de laquelle on devra renouveler le CAG !
Exercice : Traitement de pesticides par charbon actif
Une eau de forage prélevée à un débit de 60 m3.h-1 contient 2 µg.L-1 de Métazachlore. On veut réduire cette concentration à 0,01 µg.L-1 soit par adjonction de charbon actif en poudre (CAP) dans un réacteur parfaitement agité, soit par utilisation d'un filtre à charbon actif en grain (CAG) avec un temps de contact de 12 minutes.
Constantes de Freundlich du charbon actif utilisé :
Kf = 1,82 µg.mg-1.(L.µg-1)1/n
1/n = 0,13
Déterminer la dose de CAP à injecter pour atteindre cet objectif en g.m-3 et en kg.an-1
En supposant le réacteur parfaitement agité et un régime permanent, la concentration visée en sortie correspondra à la concentration à l'équilibre Ce. L'isotherme nous donne alors la masse de pesticide adsorbée par mg de CAP (qe).
Connaissant les charges en pesticides à l'entrée et en sortie, on en déduit la masse de pesticides à éliminer par unité de temps.
On déduit alors de la valeur de qe et de cette dernière masse la dose de charbon à injecter.
Déterminer la durée de vie du filtre à CAG ainsi que la quantité de CAG à renouveler. Donnée complémentaire : la densité apparente du CAG utilisé est de 450 kg.m-3.
Le temps de contact de 12 min nous donne le volume utile de CAG à mettre dans le filtre. Avec la densité apparente, on en déduit la masse de CAG installée.
Avec la dose calculée à l'exercice précédent exprimée en kg.an-1 et cette masse installée, on en déduit la durée de vie théorique du filtre au bout de laquelle on devra renouveler le CAG !
Conclusion
Les cinétiques et isothermes d'adsorption dépendent des propriétés respectives de l'adsorbant et de l'adsorbat ainsi que de la température. Les propriétés ayant une influence sur le phénomène de sorption incluent :
Pour l'adsorbant : surface spécifique, état de surface, etc.
Pour l'adsorbat : concentration, solubilité, poids moléculaire, structure moléculaire, polarité, charges, etc.
Le mise en œuvre de cette opération peut se faire au sein d'un réacteur à CAP (agité) ou d'un filtre à CAG.
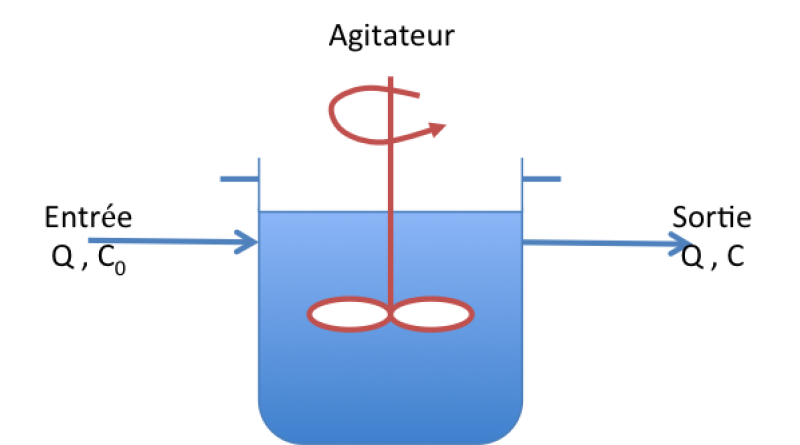

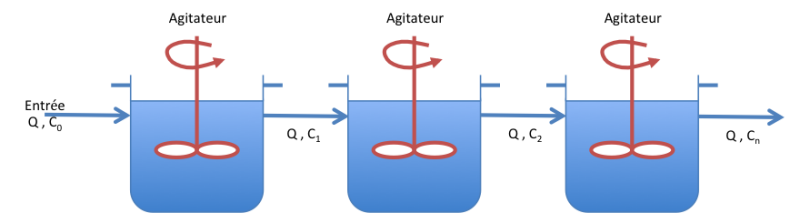
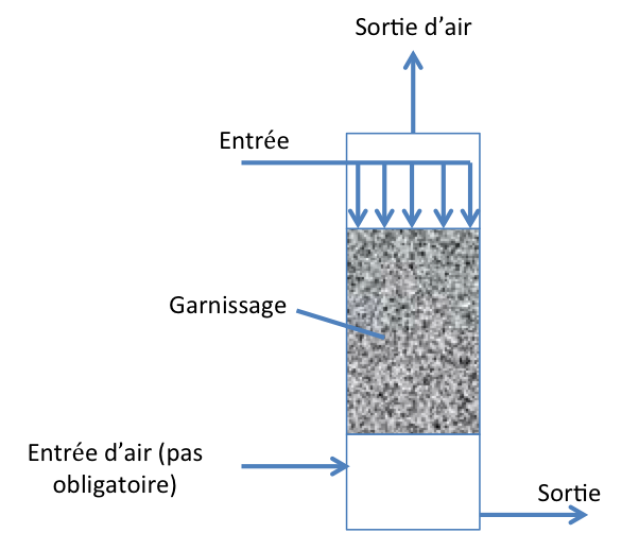
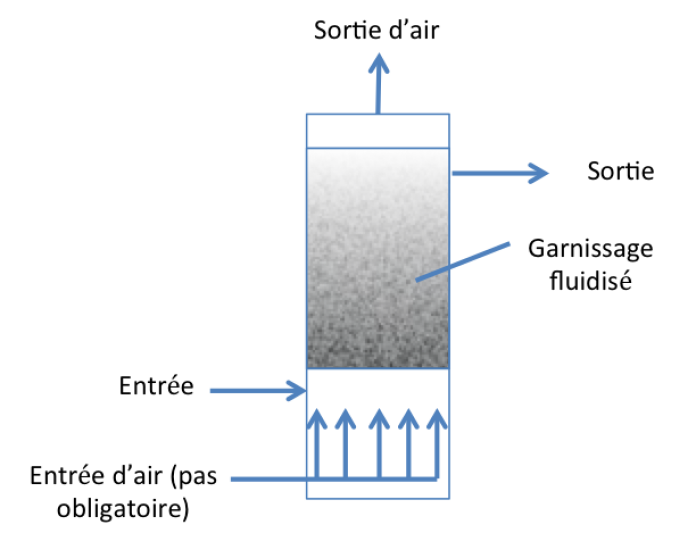
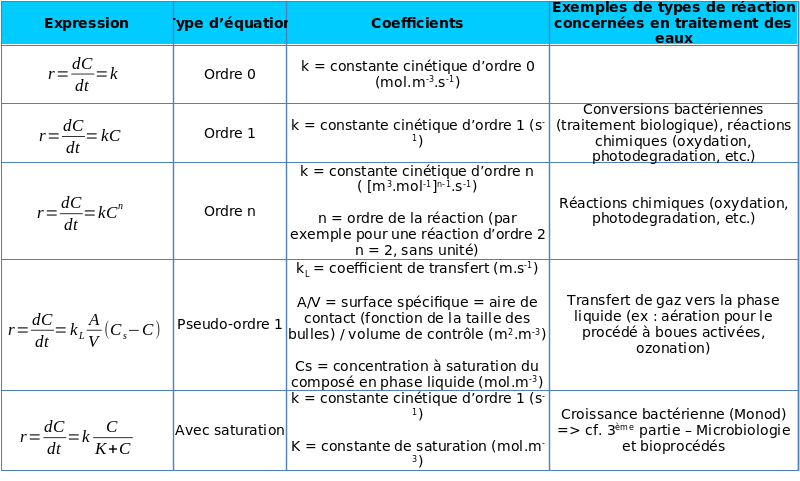
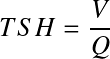
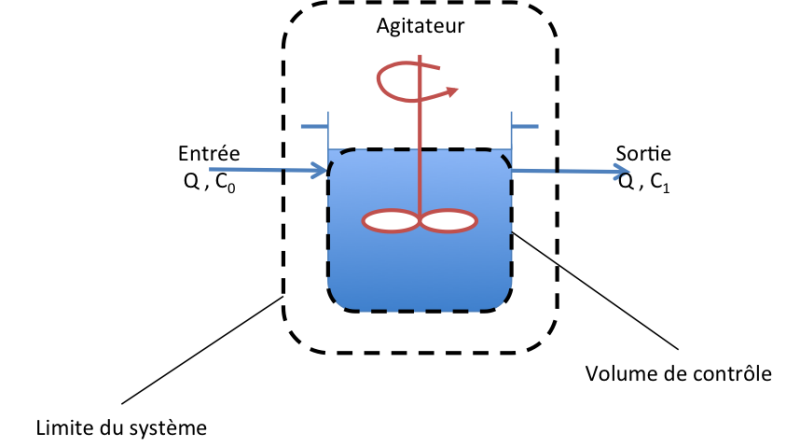
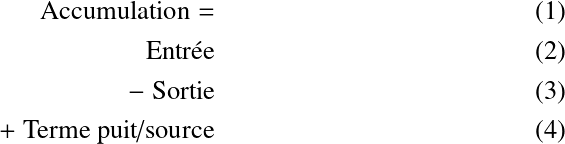
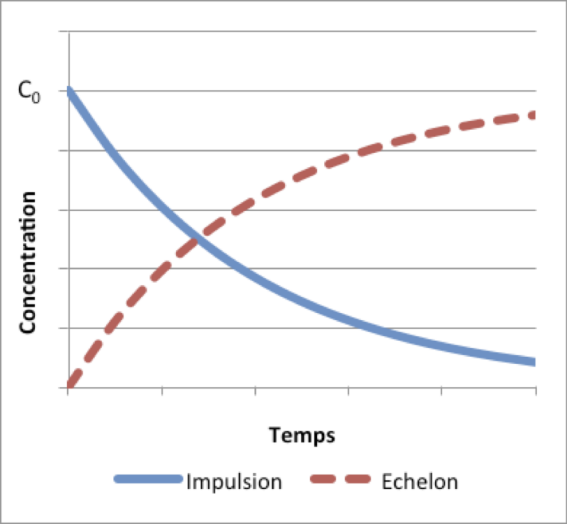
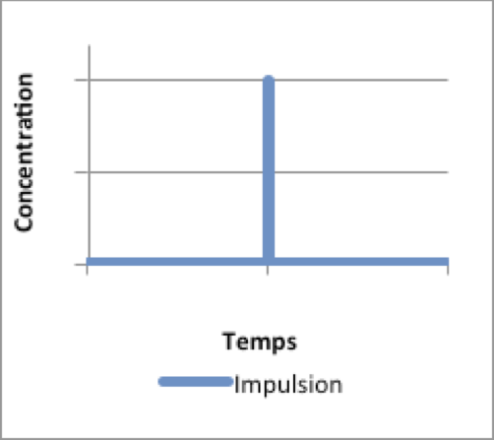
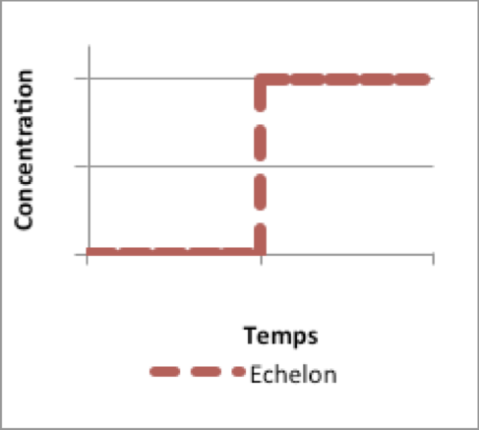
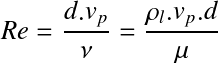
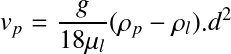
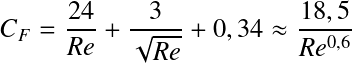
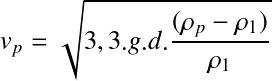
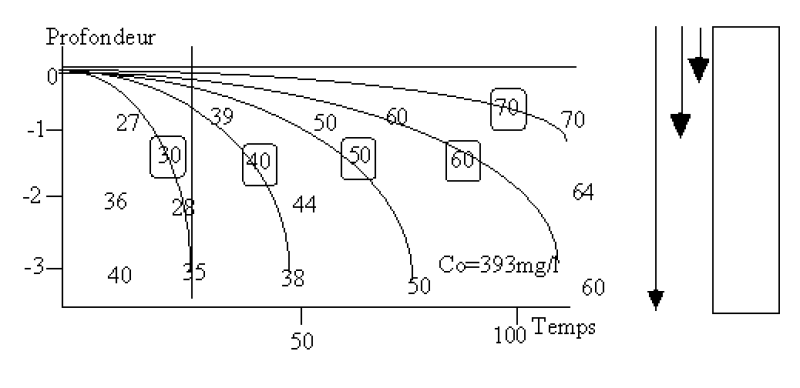
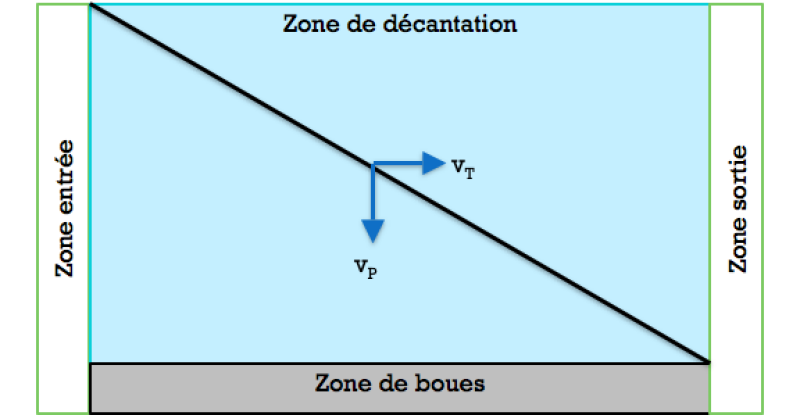
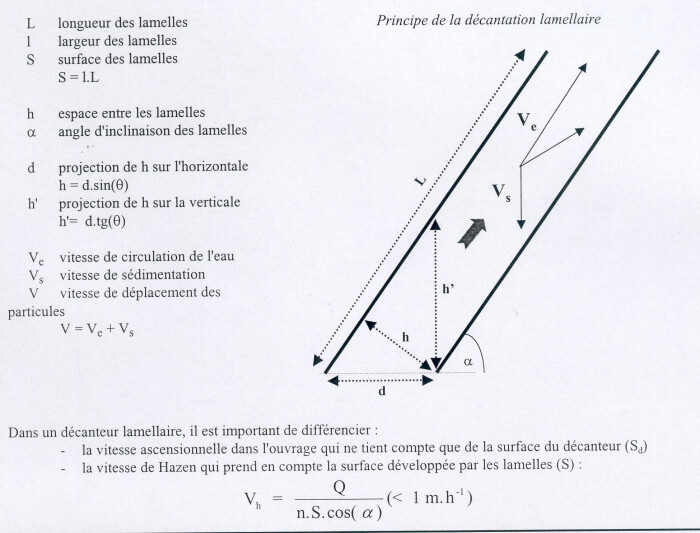
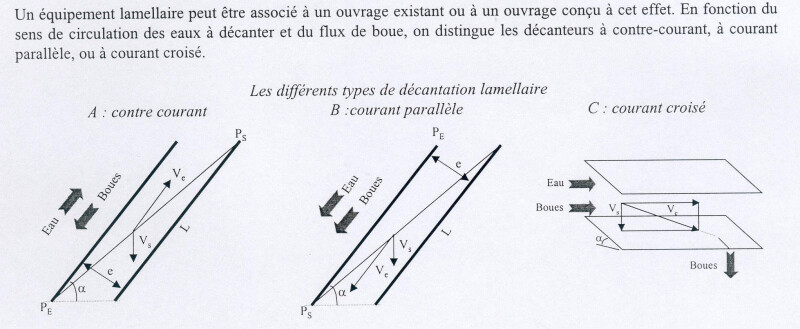
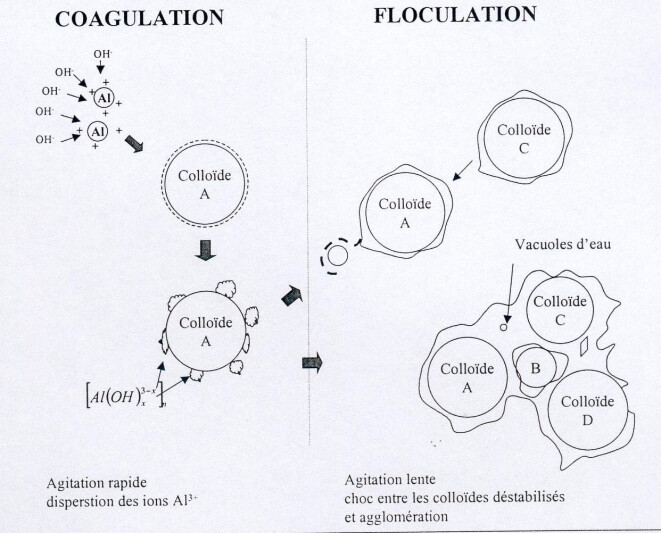
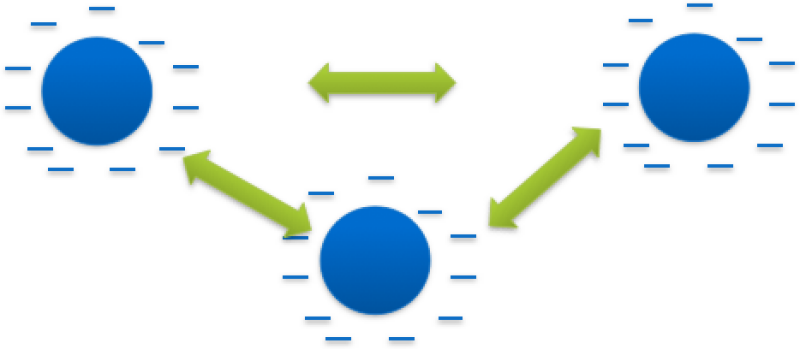
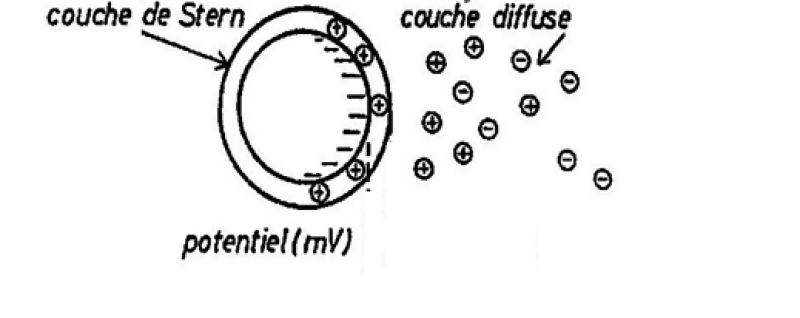
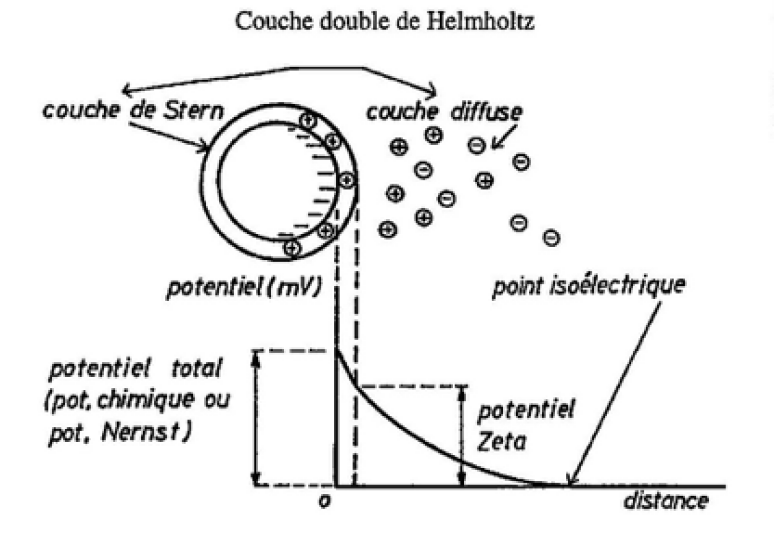
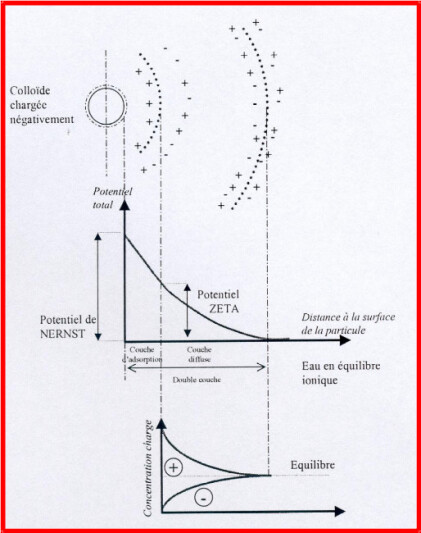
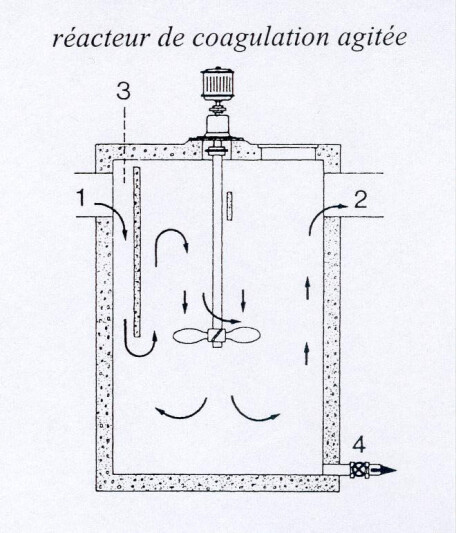

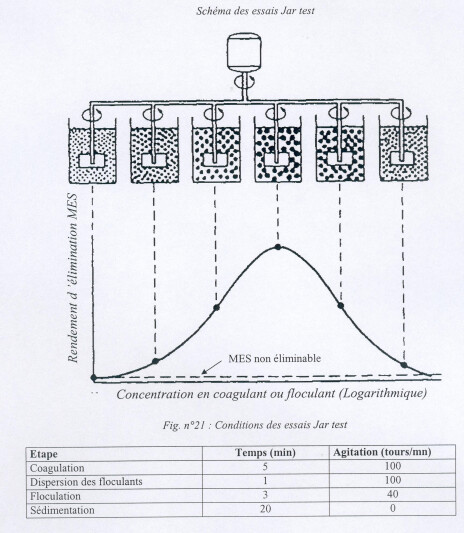

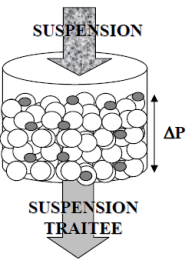
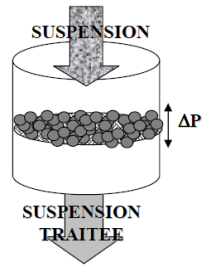
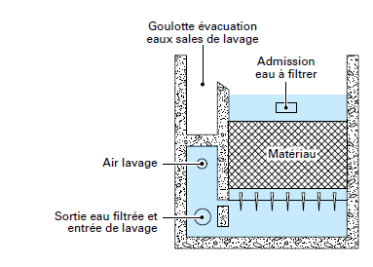
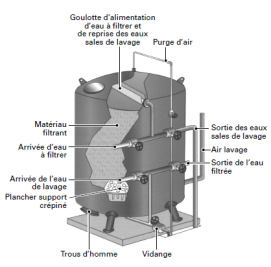
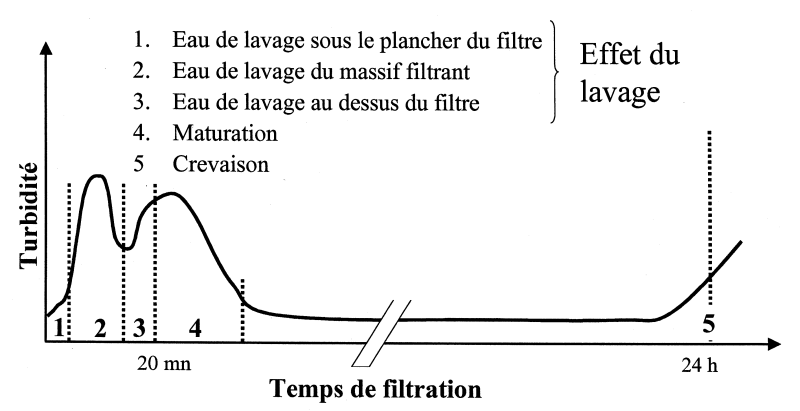
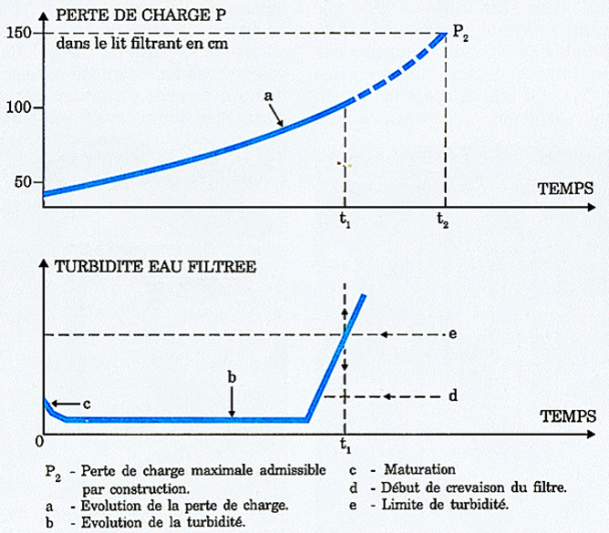
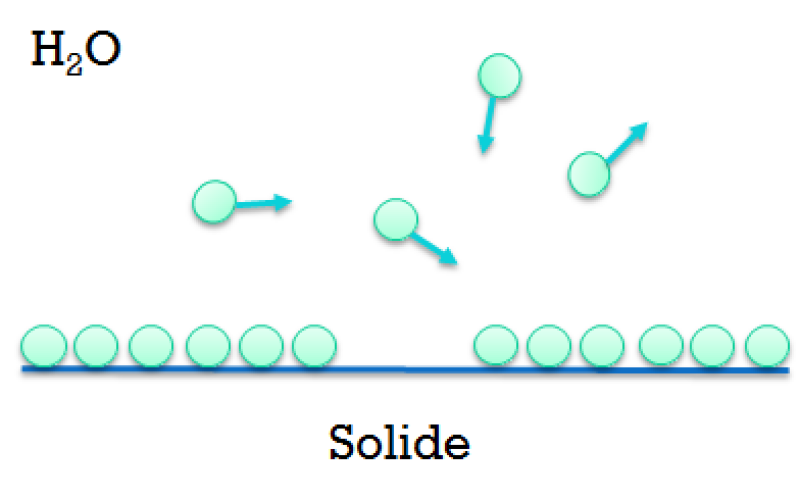
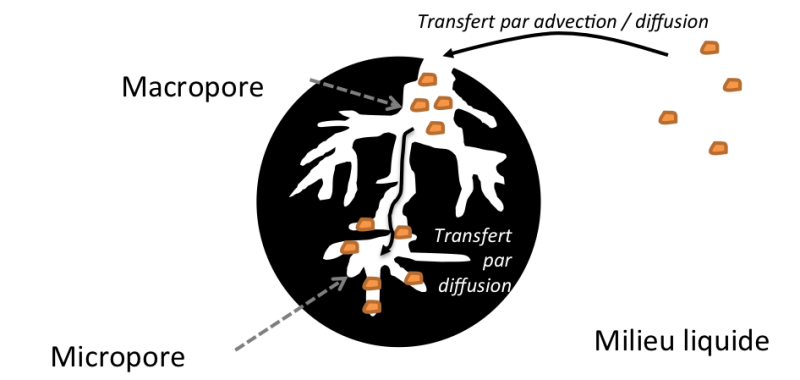
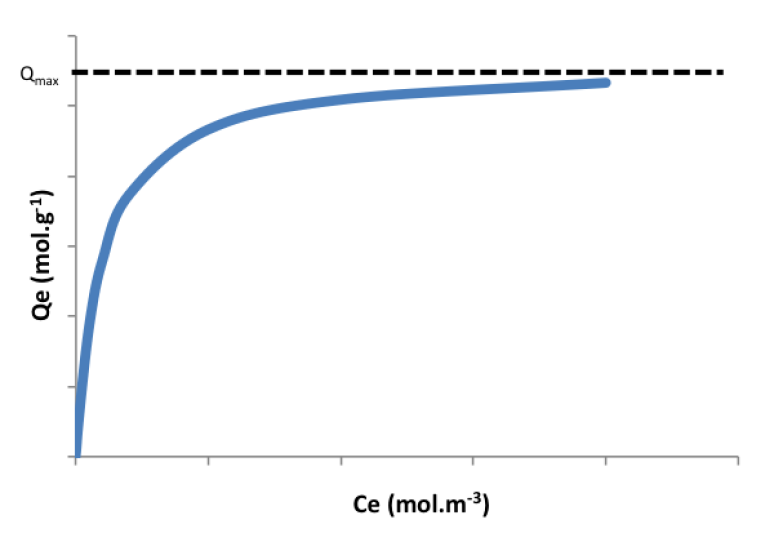
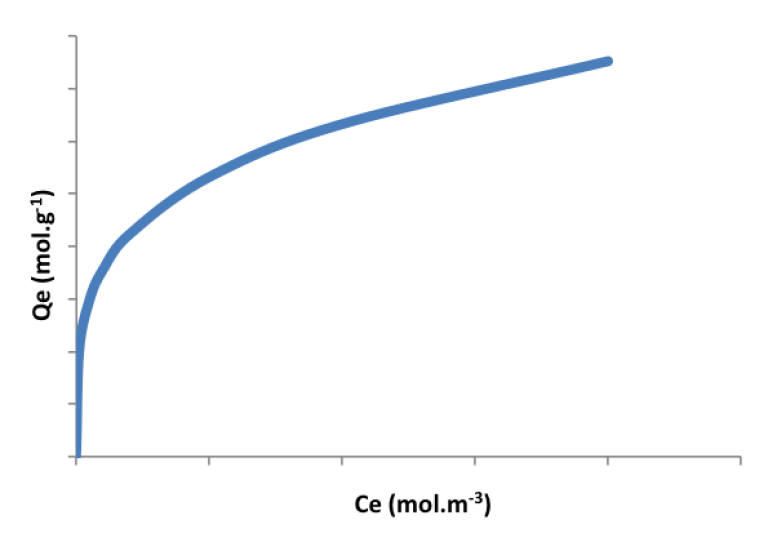

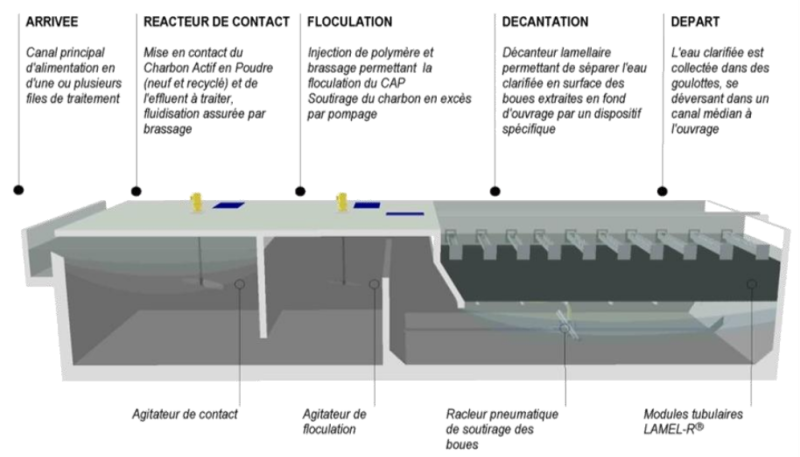




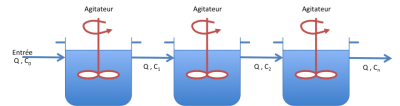
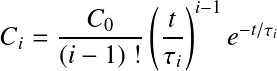
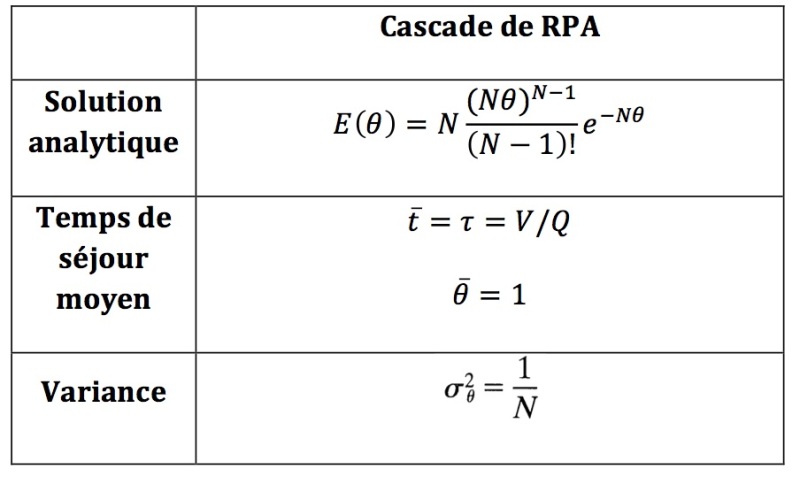
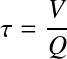
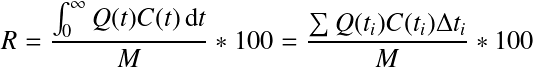
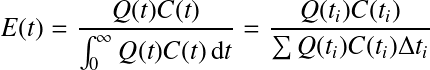
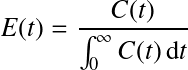
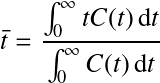
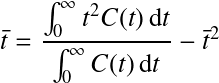
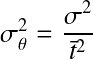
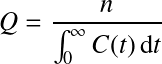

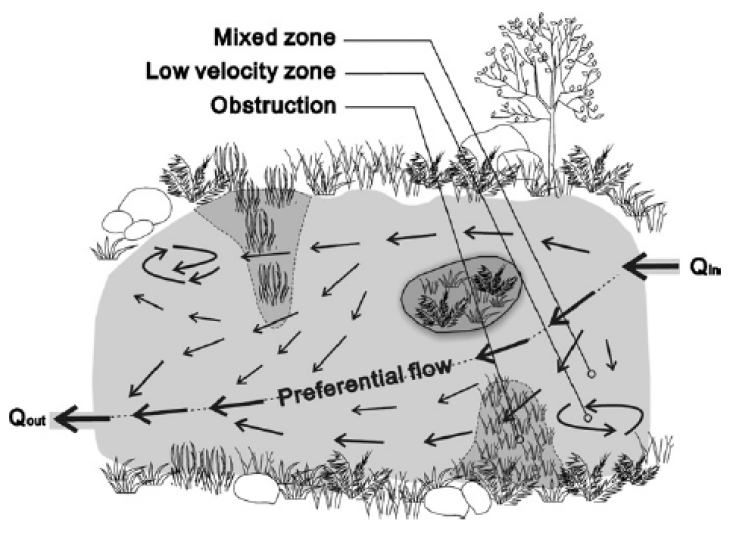
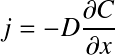
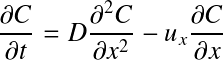
![Équation en notation Latex : C_{\theta}=\frac{1}{2 \sqrt{\pi \frac{D}{uL}}}exp \left[-\frac{(1-\theta)^2}{4\frac{D}{uL}}\right]](res/cours_reacteur_piston_dispersion.png)